
Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 21
Sebaliknya, basa kuat dapat terionisasi sempurna dalam air dan tidak membentuk reaksi kesetimbangan dengan air. Senyawa yang tergolong basa kuat hanya senyawa hidroksida yang kationnya berasal dari logam IA dan IIA. Jadi, Al(OH)3 merupakan senyawa basa lemah dengan persamaan reaksi ionisasi: Al(OH)3 ⇌ Al3+ + 3OH-.

Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Al(OH)3 yaitu rumus kimia dari Alumunium Hidroksida. Demikianlah penjelasan mengenai pengertian basa kuat, pengertian basa lemah, contoh basa kuat dan contoh basa lemah lengkap. Basa secara umum ialah sebuah senyawa kimia yang larut dalam air dan menyerap ion Hidronium dengan unsur anggota atau senyawa dimana nilai pH melebihi 7.

Teori Asam Basa
Contoh basa kuat yaitu NaOH, KOH, dan Ba(OH) 2. 2. Asam Lemah dan Basa Lemah. Asam lemah adalah senyawa asam yang sulit melepaskan ion H + dalam air dan mengalami disosiasi sebagian dalam larutannya. Contoh asam lemah yaitu H 3 PO 4, H 2 SO 3, HNO 2, dan CH 3 COOH. Basa lemah adalah senyawa basa yang sulit melepaskan ion OH - dalam air dan.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
Al(OH) 3 ini masuk golongan basa lemah andai ia dapat terurai maka peruraian pertama yang terjadi Al(OH) 3 → Al. (OH) 2 apakah termasuk jenis basa lemah atau basa kuat. Ya, ia termasuk basa lemah. Apakah kombinasi asam lemah dengan basa lemah dapat membentuk larutan penyangga. Sependek pengetahuan penulis itu tidak bisa membentuk penyangga.
Asam Basa ( Kuat & Lemah )
Termasuk larutan basa kuat adalah : NaOH, Mg (OH)2, KOH, Ca (OH)2, Sr (OH)2. Sedangkan yang dimaksud larutan basa lemah adalah yang memiliki ciri-ciri : Larutan tersebut sulit terion. Memiliki ikatan antar ion yang sulit lepas. Ikatan antar ion sulit lepas karena jarak antar inti atom pada molekul yang sangat dekat.

Asam basa
1. Asam asam merupakan salah satu penyusun dari berbagai bahan makanan dan minuman, misalnya cuka, keju, dan buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen. Ion adalah atom atau sekelompok atom.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
1. Basa Kuat - Kekuatan Basa Kuat dan Basa Lemah. Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan. Secara umum, ionisasi basa kuat dirumuskan sebagai berikut. M (OH)x(aq) ⇄ Mx+(aq) + x OH-(aq) dengan: x = valensi basa. M = konsentrasi basa.
Daftar Asam Basa Kuat Dan Lemah
Natrium yang ketemu HO bersifat basa kuat, Mg(OH) 2 bersifat basa lemah, Al(OH) 3 bersifat amfoter atau peralihan, lalu dari Si ke kanan, sifatnya udah bukan basa lagi, sifatnya menjadi asam. Jadi, sifat basa dari Na sampai Cl akan berkurang dan kebalikannya, sifat asam akan bertambah.

Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Umumnya sukar larut dalam air kecuali NH4OH, KOH, NaOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.-Basa kuat Pengertian basa kuat adalah senyawa basa yang akan terurai sempurna jika terlarut dalam air. Misalnya pada senyawa: NaOH, KOH, Ba(OH)2.-Basa lemah Pengertian basa lemah adalah senyawa basa yang tidak sempurna proses pelarutan atau terurainya jika ada.

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Dari situlah bisa ditentukan apakah larutan tersebut termasuk dalam basa kuat atau lemah. Selain itu, kekuatan basa juga bisa ditentukan oleh tetapan kesetimbangannya, yaitu tetapan ionisasi basa (Kb).. Larutan KOH merupakan basa kuat, sedangkan Al(OH)3 dan NH4OH termasuk basa lemah. ———-Demikian pembahasan mengenai larutan basa.

Al Oh 3 Hno3 EDUCA
larutan basa kuat (NaOH, KOH, BaOH, CaOH, LiOH, Mg(OH) 2), dan larutan garam (NaCl). Larutan elektrolit lemah. Kebalikan dari elektrolit kuat, larutan elektrolit lemah tidak dapat terurai secara sempurna menjadi ion atau hanya mengalami ionisasi sebagian, sehingga jumlah zat yang terurai menjadi ion pun sedikit dan menjadi penghantar listrik.

MENGHITUNG PH ( LARUTAN ASAM & BASA) Belajar Asyik
Kation dari basa kuat di atas terdapat pada grup pertama dan kedua pada daftar periodik (alkali dan alkali tanah). Asam dengan pK a lebih dari 13 dianggap sangat lemah, dan basa konjugasinya adalah basa kuat. Beberapa basa kuat seperti kalsium hidroksida sangat tidak larut dalam air. Hal itu bukan suatu masalah - kalsium hidroksida tetap.
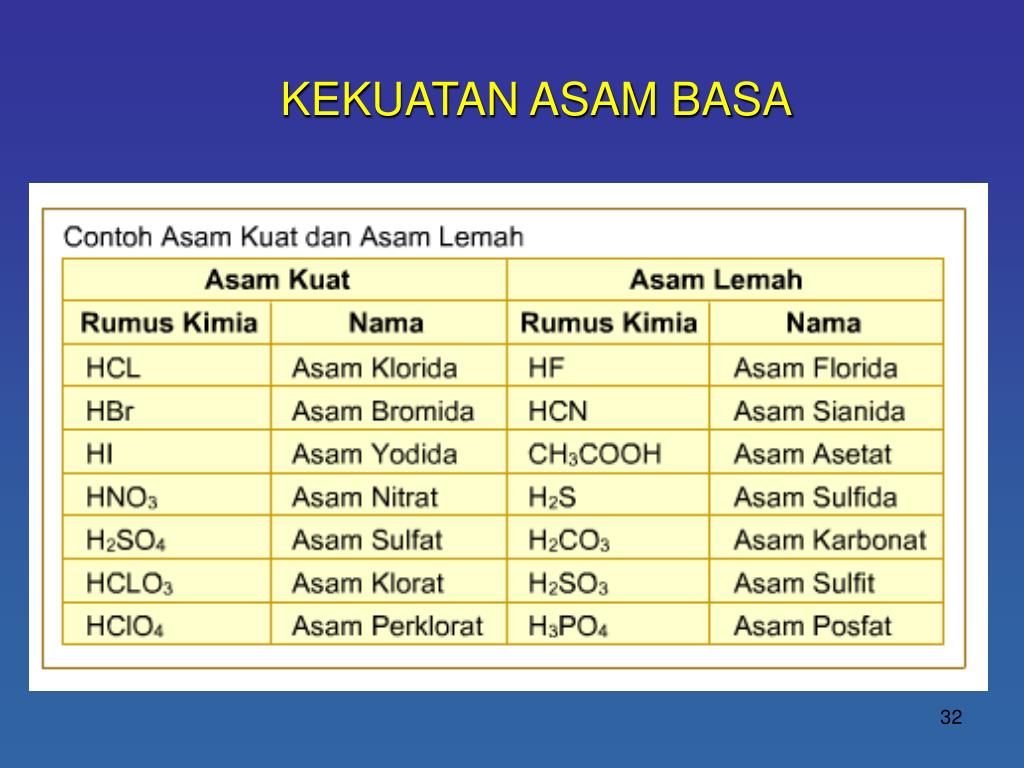
Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
Berikut adalah pengertian dan contoh dari basa kuat dan basa lemah! Basa kuat. Dilansir dari Chemistry LibreTexts, basa kuat adalah basa yang terionisasi secara sempurna ke dalam air. Ketika larut dalam air, setiap molekul basa kuat akan melepaskan ion hidroksida (OH-). Basa kuat memiliki pH yang tinggi, biasanya lebih besar dari 11.

Daftar Asam Basa Kuat Dan Lemah
03 Maret 2023 Lili Y. Bagikan. 28 Contoh Asam Basa Kuat dan Asam Basa Lemah Beserta Reaksi Ionisasinya - Ketika kamu menambahkan soda kue ke cuka, maka akan menyebabkan gelembung dan busa. Ini merupakan reaksi antara asam dan basa. Asam dan basa dicirikan oleh pertukaran ion hidrogen. Asam adalah molekul yang menyumbangkan satu ion hidrogen.

Asambasa menentukan konsentrasi ion OH dalam basa kuat YouTube
Al(OH) 3 merupakan basa yang sangat lemah sekaligus asam yang sangat lemah karena sukar larut dalam air (K sp = 2 x 10-32 mol 4 /L 4). Karena Al(OH) 3 dapat bersifat asam dan basa, maka disebut juga sebagai zat amfoter.. bersifat lemah atau kuat? 0. Reply. Chelonia Mydas. 12 years ago

MENENTUKAN VALENSI BASA kuat YouTube
Kekuatan basa alkali tidak berkaitan dengan seberapa kaustiknya hidroksida tersebut. Dilansir dari Chemistry LibreTexts, kekuatan basa adalah ukuran seberapa mudahnya molekul terionisasi dalam air. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah. Basa yang paling kuat adalah basa yang paling mudah terionisasi dalam air. Artinya, makin.