
Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Unsur bebas dengan bentuk atom, sebagai contoh: Cu, K, Ca, C, Nae, Fe, Al, Na;. Jadi terbukti jika bilangan oksidasi H bertemu logam (Al) adalah -1. 8. Bilangan Oksidasi Oksigen (O) adalah -1 dalam Senyawa Peroksida dan -2 dalam Senyama Non-Peroksida. Contoh dari penerapan aturan ini seperti misalnya pada H 2 O 2 (hidrogen peroksida.
Cara Menentukan Bilangan Oksidasi dan Contohnya
Aturan menentukan bilangan oksidasi dijabarkan pada poin-poin di bawah ini: Bilangan oksidasi atom F yaitu -1. Atom logam selalu mempunyai bilangan oksidasi positif dengan harga yang sesuai pada nomor golongannya, kecuali dengan logam transisi yang mempunyai biloks lebih dari satu. - Bilangan oksidasi Li, Na, K, Rb, dan Cs yaitu +1.

g
Bilangan oksidasi atom dalam unsur bebas netral sama dengan nol. Contohnya, biloks Fe, Li, Na, O2, dan P4 sama dengan nol.. Bilangan oksidasi ion poliatomik sama dengan muatan keseluruhan ion, misalnya biloks NH4+ adalah +1 dan biloks SO4 2- adalah -2. Bilangan oksidasi oksigen dalam senyawa peroksida adalah -1 dan dalam enyawa non peroksida.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10 Belajar Gratis di Rumah
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1

Contoh Soal Reduksi Oksidasi
Tetapkan bilangan oksidasi -2 pada oksigen (tanpa perkecualian). Dalam hampir semua kasus, atom oksigen memiliki bilangan oksidasi -2. Ada beberapa perkecualian dalam peraturan ini: Saat oksigen berada dalam bentuk unsur (O 2 ), bilangan oksidasinya adalah 0, karena ini adalah peraturan untuk semua atom unsur.

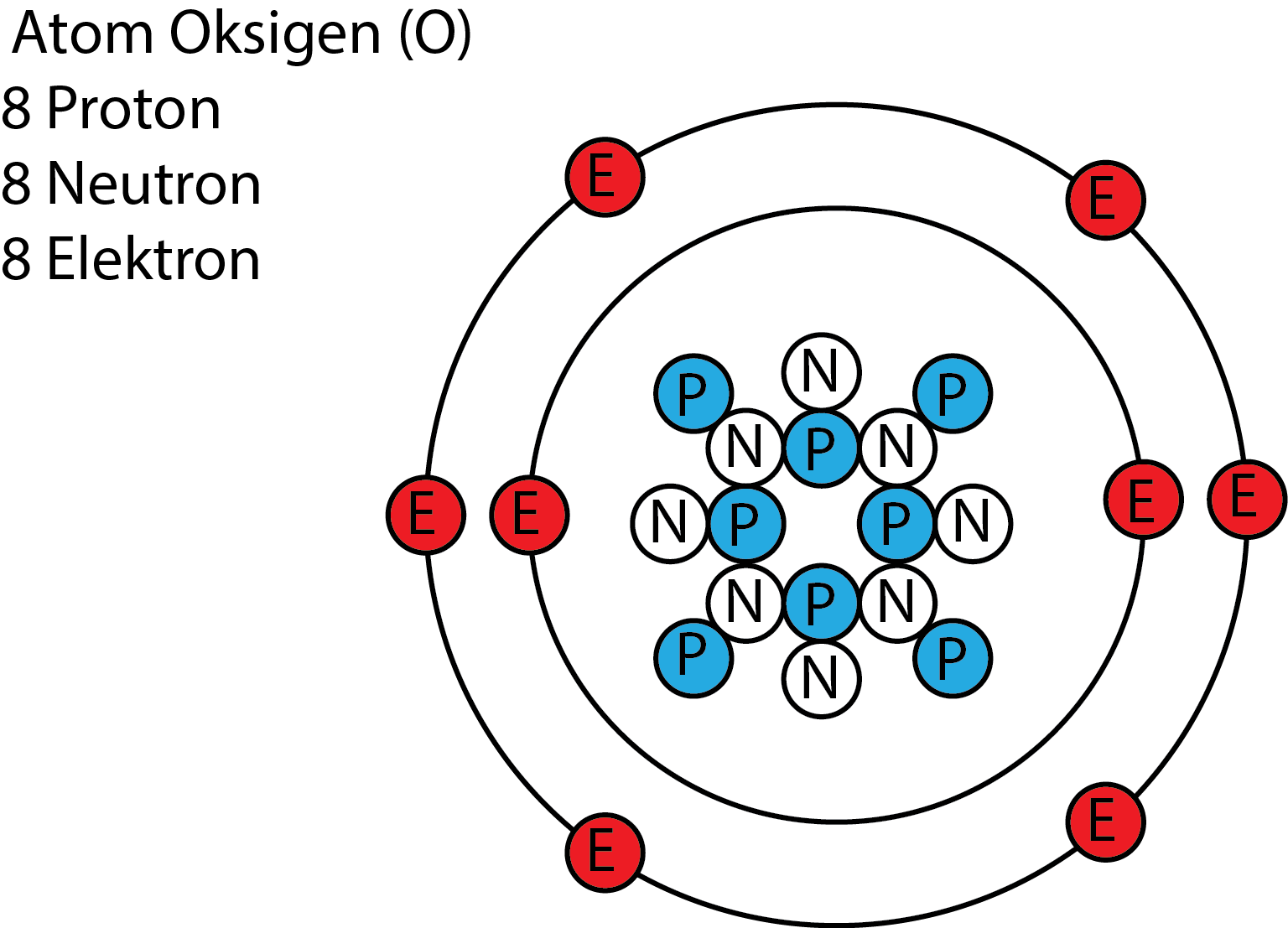
Struktur Atom Oksigen MateriKimia
Ion monoatomik adalah ion yang hanya terdiri dari satu atom. Bilangan oksidasinya sama dengan muatannya. Contoh: Bilangan oksidasi pada Li+, Na+, K+,dan Ag+ adalah +1.. Bilangan Oksidasi Oksigen dalam Senyawanya Adalah -2. Bilangan oksidasi oksigen dalam senyawanya adalah -2, kecuali dalam senyawa peroksida dan OF2. Contoh: Bilangan oksidasi.

Pada reaksi 2CO+2NO > 2CO2+N2 Bilangan oksidasi C beru...
S O 2 SO_2 Tentukan bilangan oksidasi sulfur S S dan oksigen O O . Bilangan oksidasi sulfur adalah +4, dan oksigen -2. Nama senyawa ini menjadi "sulfur dioxide." Contoh Soal Redoks. Tentukan apakah reaksi berikut merupakan reaksi oksidasi, reduksi, atau reaksi redoks. Tuliskan bilangan oksidasi dari setiap unsur yang.

Banyaknya atom oksigen dalam Al2(SO4)3 adalah.
Zn (s) + Cu2+(aq) → Zn2+(aq) + Cu (s) Reaksi keseluruhan adalah jumlah dari kedua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi yang disebut reaksi redoks. Reaksi di atas menunjukkan terjadinya pelepasan dan pengikatan elektron, maka dapat disimpulkan sebagai berikut. Oksidasi adalah peristiwa pelepasan elektron.

Jumlah atom oksigen dalam senyawa kapur Ca(OH)2 adalah
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Nilai Bilangan Oksidasi Dari S Didalam Na2so 3 Adalah peristiwa yang terjadi pada fabel
Aturan dalam Menentukan Bilangan Oksidasi. 1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya.

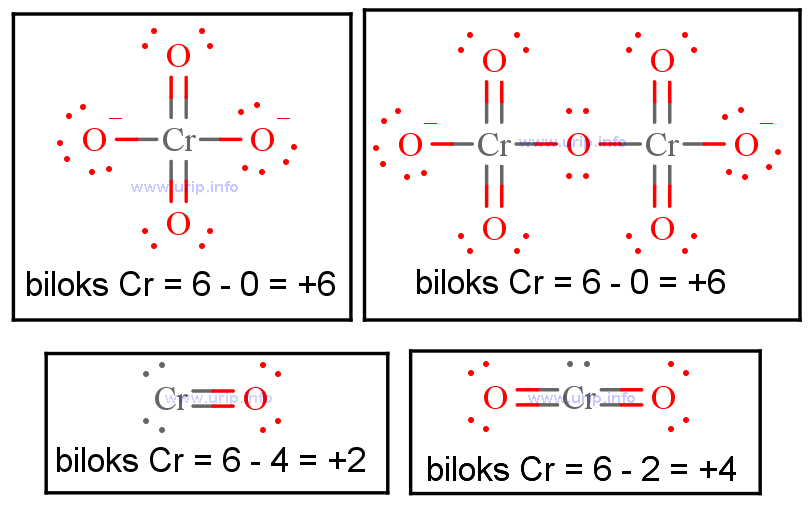
Tentukan bilangan oksidasi atom pusat dan nama senyawa ko...
Bedakan dengan bilangan oksidasi. Dalam kimia, keadaan oksidasi merupakan indikator derajat oksidasi sebuah atom dalam suatu senyawa kimia.Keadaan oksidasi formal merupakan muatan hipotetis yang suatu atom peroleh apabila semua ikatan yang berikatan dengan atom tersebut adalah sepenuhnya bersifat ionik.Keadaan oksidasi berupa bilangan bulat, ia dapat berupa nilai positif, negatif, ataupun nol.

Cara Menentukan Bilangan Oksidasi yang Mudah, Berikut Penjelasannya
Bilangan oksidasi atom F yaitu -1. Atom logam selalu mempunyai bilangan oksidasi positif dengan harga yang sesuai pada nomor golongannya, kecuali dengan logam transisi yang mempunyai biloks lebih dari satu. - Bilangan oksidasi Li, Na, K, Rb, dan Cs yaitu +1. - Bilangan oksidasi Be, Mg, Ca, Sr, Ba, dan Ra yaitu +2. - Bilangan oksidasi Al yaitu +3.
Catatan tentang Bilangan Oksidasi Serba Ada
Pengertian Bilangan Oksidasi (Biloks) Bilangan oksidasi (biloks) adalah bilangan positif atau negatif yang menunjuk pada muatan suatu spesies bila elektron-elektron dianggap terdistribusi pada atom-atom menurut aturan tertentu. Aturan distribusi ini adalah secara ionik bagi spesies heteronuklir yang artinya terjadi perpindahan elektron kepada.

Bilangan Oksidasi Atom Mn YouTube
Bilangan oksidasi unsur S pada Na 2 S dan MgS adalah -2. Bilangan oksidasi unsur Cl pada NaCl, KCl, MgCl 2, dan FeCl 3 adalah -1. 5. Bilangan oksidasi unsur H pada senyawanya adalah +1.' Kecuali dalam hidrida (senyawa hydrogen dengan logam), bilangan oksidasinya -1′ Alasan: dalam senyawa hidrida, hidrogen ada dalam bentuk ion hidrida, H.

Representasi Geometri Struktur Atom Oksigen YouTube
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.
Molekul Unsur dan Senyawa Kimia Kenal Sains
Sifat atom; Bilangan oksidasi: −2, −1, 0, +1, +2: Elektronegativitas: Skala Pauling: 3,44 :. Keadaan oksidasi oksigen adalah -2 untuk hampir semua senyawa oksigen yang diketahui. Keadaan oksidasi -1 ditemukan pada beberapa senyawa seperti peroksida. Senyawa oksigen dengan keadaan oksidasi lainnya sangat jarang ditemukan, yakni -1/2.