
LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H +) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen.Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Trik Menentukan Pasangan Asam Basa Konjugasi KIMIA OKE PINTAR
1. Kekuatan Asam Basa: Asam yang lebih kuat akan memiliki basa konjugasi yang lebih lemah, dan sebaliknya.Contohnya, asam kuat seperti asam sulfat (H2SO4) akan memiliki basa konjugasi yang lemah, yaitu ion sulfat (SO4^2-). 2. Konstanta Disosiasi Asam: Pasangan asam basa konjugasi memiliki nilai konstanta disosiasi asam (Ka) yang berbeda.Ka menyatakan sejauh mana asam akan melepaskan protonnya.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Istilah asam-basa konjugasi ini muncul dalam Teori Asam-basa Brønsted-Lowry. Istilah asam-basa konjugasi merupakan sentral dalam bahasan kesetimbangan asam-basa di SMA/MA, yang di dalamnya terdiri bahasan larutan penyangga atau larutan bufer serta hidrolisis garam. Penentuan manakah yang termasuk pasangan asam-basa konjugasi dan basa-asam.

PPT TEORI ASAM BASA PowerPoint Presentation, free download ID5368090
Sedangkan basa konjugasi adalah ion yang diperoleh setelah asam kehilangan proton (H+). Kedua reaksi ini bisa terjadi reversibel atau dibalik. Baca juga: Rangkuman Teori Asam Basa Menurut Arrhenius, Bronsted-Lowry & Lewis. Baca juga artikel terkait ASAM BASA atau tulisan menarik lainnya Cicik Novita

asam basa konjugasi soal kimia SMA YouTube
Reaksi NH4 ke NH3. Asam Basa Konjugat - Konjugasi Asam Basa - Rumus, Konjugat, Contoh Soal dan Jawaban. Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium.Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air.

Cara mencari Pasangan AsamBasa konjugasi AsamBasa YouTube
A conjugate acid, within the Brønsted-Lowry acid-base theory, is a chemical compound formed when an acid gives a proton ( H +) to a base —in other words, it is a base with a hydrogen ion added to it, as it loses a hydrogen ion in the reverse reaction. On the other hand, a conjugate base is what remains after an acid has donated a proton.
Asam Basa Konjugat Konjugasi Asam Basa Rumus, Soal dan Jawaban
Access the application for temporary selection for studies. 3. Prepare your documents. After submitting your application, you will receive a personalized checklist of documents to submit. Documents vary depending on your country of residence or origin. You can also consult the Documents to submit for your application page.

Asam Basa Bronsted Lowry Bagian 3 (Asam Basa Konjugasi) Materi Asam Basa Kimia SMA Pojan
Asam dan Basa Konjugasi - RumusKimia.net berikut akan berbagi penjelasan tentang Asam dan Basa Konjugasi. Untuk pengertian Asam dan Basa Konjugasi. Rumus Kimia. KURIKULUM 2013; Kimia KELAS 10; Kimia KELAS 11; Kimia KELAS 12; ×. Beranda › Kimia SMA Kelas 11. Asam dan Basa Konjugasi dengan Contoh Soal.

Mengenal buffer dalam sel (Pasangan asambasa konjugasi H2PO4 dan HPO42) YouTube
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H+) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen. Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Asam basa konjugasi kimia SMA YouTube
Sementara H 3 O + adalah asam konjugasi karena kelebihan ion H + dibandingkan zat asalnya, yaitu H 2 O. Pasangan CH 3 COOH dan CH 3 COO- disebut pasangan asam basa konjugasi. Dalam teori asam basa Bronsted Lowry, ada kondisi dan reaksi tertentu di mana suatu senyawa dapat berperan sebagai basa meskipun tidak mengandung OH-, sedangkan dalam.
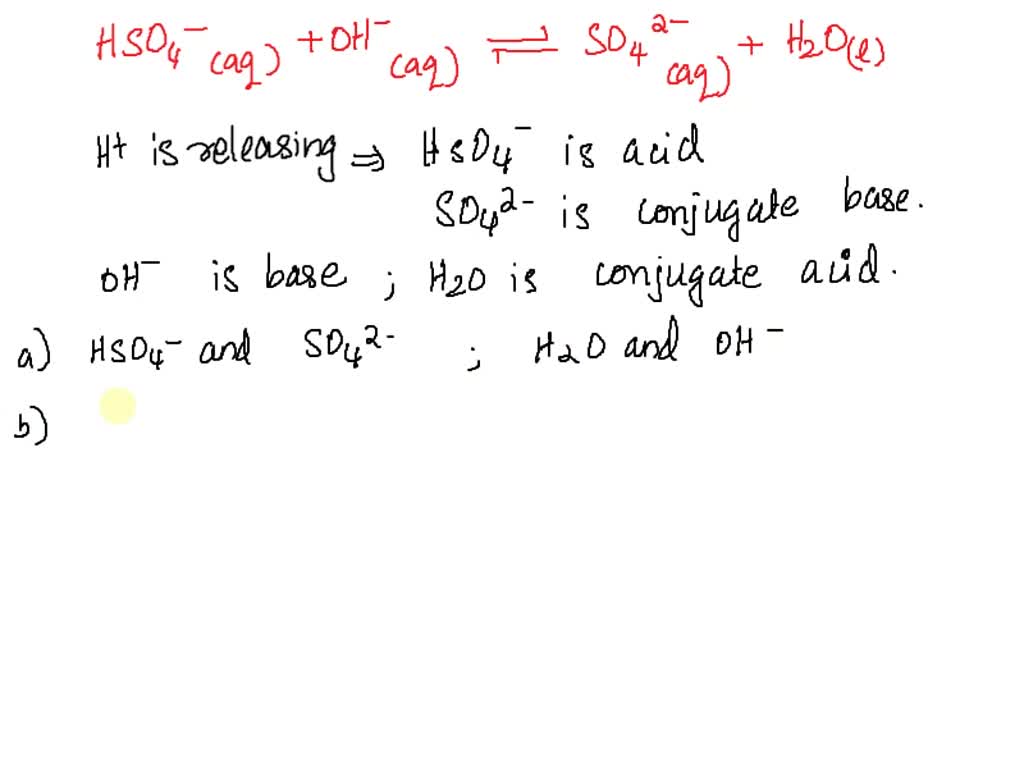
SOLVED pasangan asam basa konjugasi dari reaksi hso4(aq) + h2o(l) = h3o+(aq) + so4 2(aq) adalah
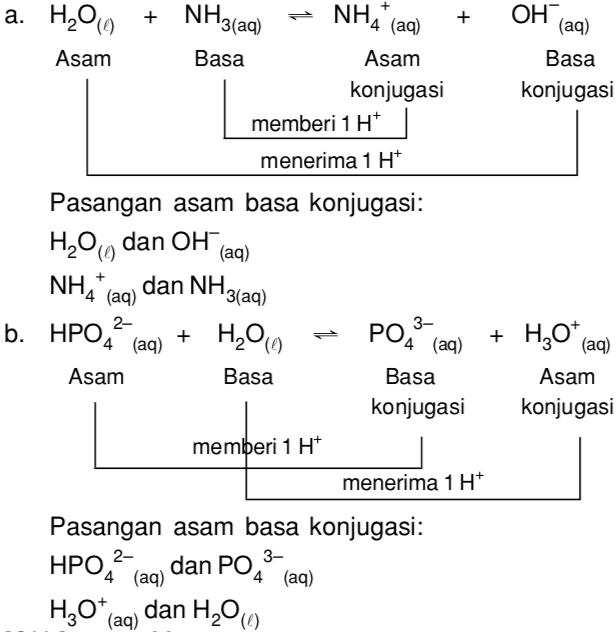
Sisa asam tersebut dinyatakan sebagai basa konjugasi. Demikian pula untuk basa, jika suatu basa dapat menerima proton (H +), maka zat yang terbentuk mempunyai kemampuan sebagai asam disebut asam konjugasi. Pada reaksi tersebut terlihat bahwa H 2 O dapat bersifat sebagai asam dan basa. Zat yang demikian disebut zat amfoter.
Asam Dan Basa Konjugasi Dengan Contoh Soal Rumus Kimia Riset
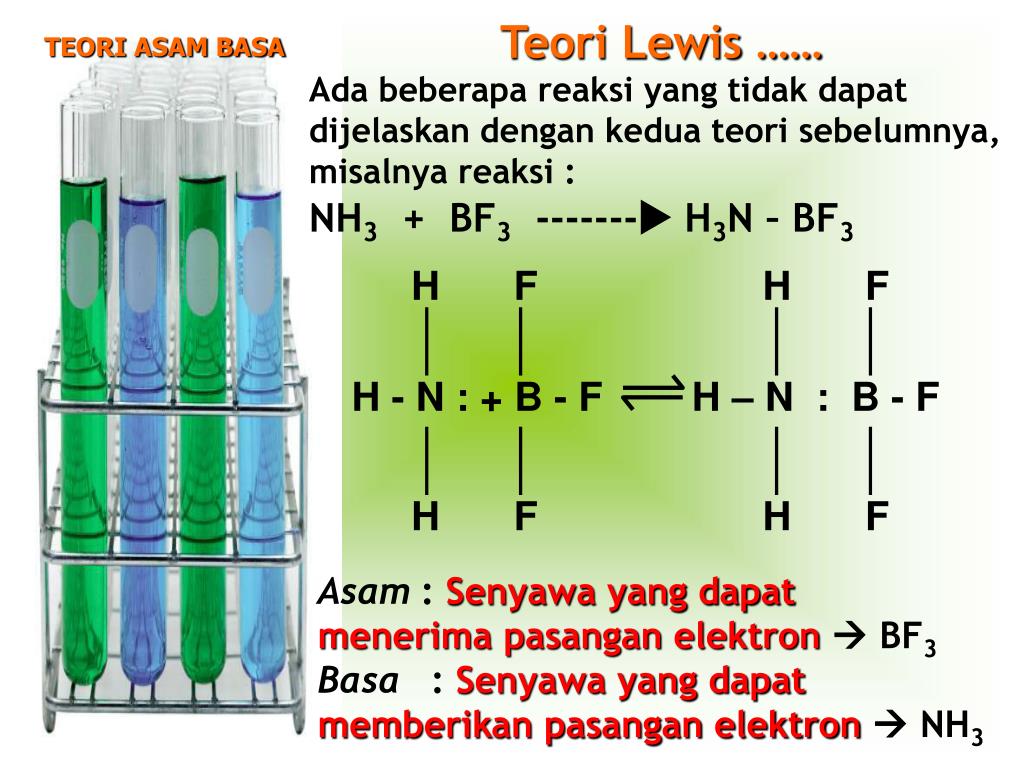
Asam konjugasi adalah basa yang memperoleh ion hidrogen, sedangkan basa konjugasi adalah yang tersisa setelah asam memberikan proton dalam sebuah reaksi kimia. Kedua hal tersebut disebut pasangan asam basa konjugasi. Teori Asam Basa Lewis. Asam basa Lewis menjelaskan terkait struktur dan ikatannya. Asam menurut Lewis adalah zat yang punya.

Asam basa konjugasi soal kimia SMA YouTube
Pengertian basa konjugasi. Menurut Bronsted Lowry asam adalah spesies apa pun yang menyumbangkan proton (H+). Dilansir dari Chemistry LibreTexts, asam yang kehilangan proton berubah menjadi basa konjugasinya. Misalnya, senyawa asam Bronsted HF yang direaksikan dengan air dengan reaksi berikut:
PPT TEORI ASAM BASA PowerPoint Presentation, free download ID5368090
Video berisi tentang cara menentukan pasangan asam basa konjugasi dari teori asam basa Bronsted-Lowry. Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semu.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
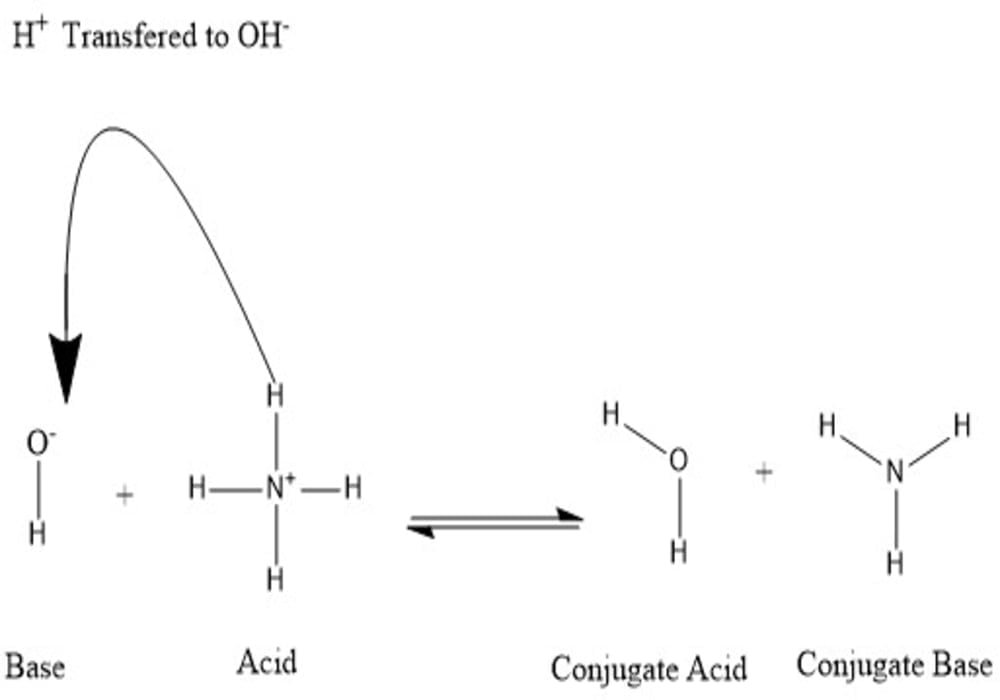
Dari gambar terlihat bahwa air yang telah melepaskan proton berubahn menjadi basa konjugasi OH-. Dan ammonia (NH3) yang telah menerima donor proton berubah menjadi asam konjugasi NH4+. Sehingga pasangan asam basa konjugasinya adalah H2O dan NH3, juga OH- dan NH4+. Kita dapat menentukan mana asam konjugasi mana basa konjugasi dari reaksi.
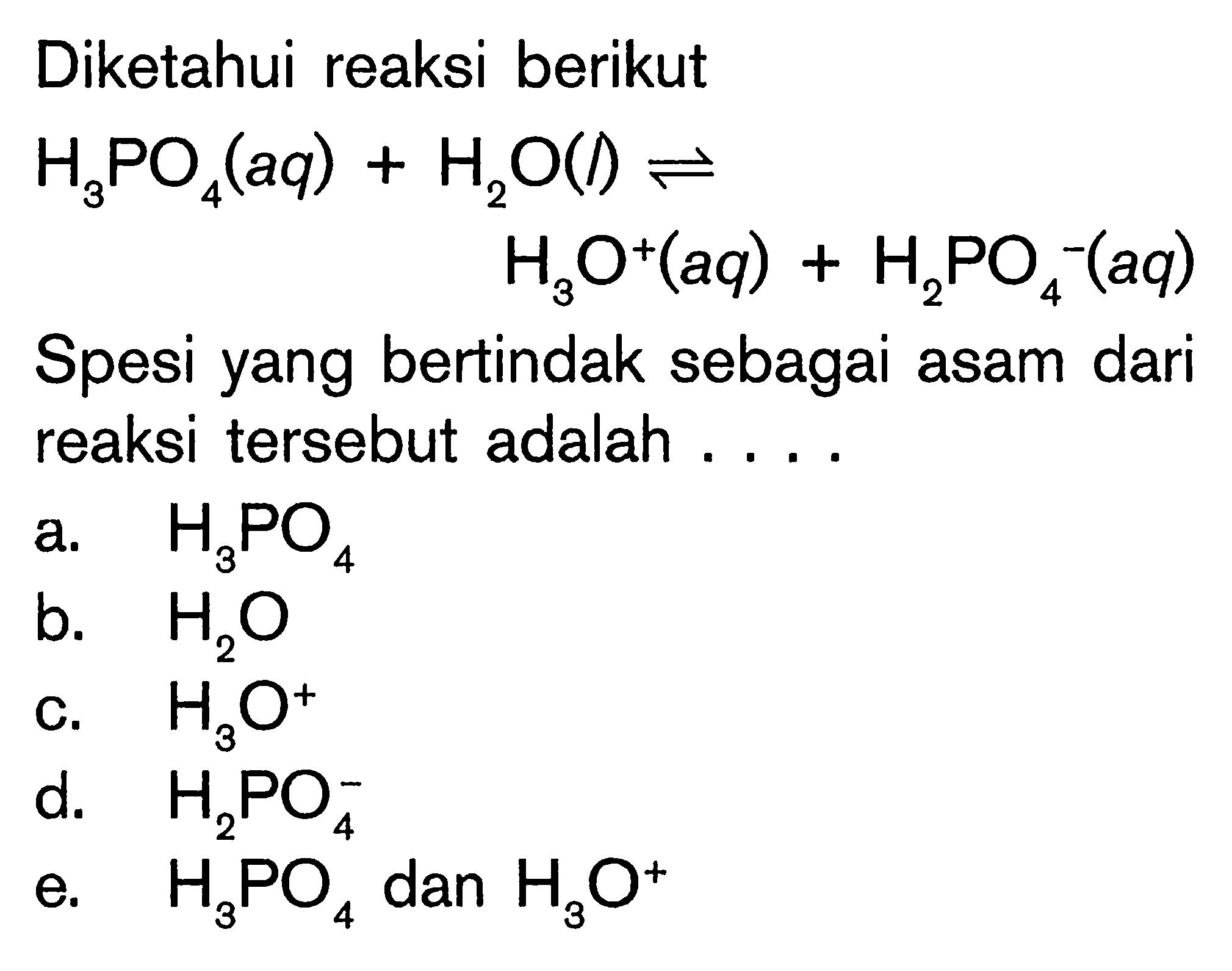
Sebutkan pasangan asambasa konjugasi dari reaksi berikut...
Mengenali basa konjugasi asam monoprotik biasanya mudah, namun, dalam kasus asam poliprotik, beberapa kebingungan dapat muncul. Ini karena kita terkadang menulis reaksi disosiasi asam seperti H 2 SO 4 sebagai kehilangan kedua proton dalam satu langkah. Namun, bukan ini yang sebenarnya terjadi.