
Materi Penurunan Tekanan Uap Sekolah Siswa
The average wind speed is 13 kph (8 mph). August is generally a very hot month. The average temperature is of 30.5 °C (87 °F), with a minimum of 24 °C (75.2 °F) and a maximum of 37 °C (98.6 °F). On the coldest nights of the month, the temperature usually drops to around 20.5 °C (68.5 °F).

tentukan penurunan tekanan uap jenuh larutan yang
ΔP = P ∘ − P. Tekanan uap larutan ideal dapat dihitung berdasar hukum Raoult yang berbunyi: "Tiap komponen dalam suatu larutan melakukan tekanan yang sama dengan fraksi mol kali tekanan uap dari komponen (pelarut) murni". P = Xt ⋅ P ∘ dan P = Xp ⋅ P ∘.

Contoh Soal dan Pembahasan Penurunan Tekanan Uap (ΔP) Post 2 Chemistry is Fun
Tekanan uap pelarut murni (air) adalah 27,3mmHg. 10% Glukosa menunjukkan bahwa larutan tersebut mengandung 10% massa glukosa dan 90% massa air. Jika kita anggap massa larutan adalah 100 gram, maka massa glukosa dan air sebagai berikut Tekanan uap larutan adalah 27,029 mmHg. Maka penurunan tekanan uapnya adalah Jadi, penurunan tekanan uap.

Video Penurunan Tekanan Uap Larutan YouTube
Pembahasan. Adanya zat terlarut nonvolatil pada pelarut murni, akan menyebabkan tekanan uap larutan selalu lebih rendah dari pelarut murninya. Glukosa yang terlarut dalam air murni, akan menyebabkan tekanan uap larutan lebih rendah. Tekanan uap pelarut murni (air) adalah 25,21 mmHg. Tekanan uap larutan dapat dihitung dengan rumus berikut.

Tekanan Uap Larutan Urea Pada Suhu C Mmhg Jika Tekanan Uap My XXX Hot Girl
Teman-teman kelas 12, kita belajar tentang tekanan uap dan penurunan tekanan uap, yuk! Simak penjelasan dan lihat contoh soalnya, ya!. Larutan yang memiliki tekanan uap paling tinggi adalah larutan dengan penurunan tekanan uap paling kecil. Oleh karena itu, nilai fraksi mol pun zat terlarut juga harus yang paling kecil. Larutan 1 hanya.

Pengertian Dan Contoh Soal Penurunan Tekanan Uap Reverasite
Contoh Soal Penurunan Tekanan Uap Larutan. 1. Tekanan uap air pada suhu 25 0C adalah 23,76 mmHg. Jika pada suhu yang sama, kedalam 900 mL air ditambahkan urea (Mr = 60 g/mol), tekanan uap larutan menjadi 22,84 mmHg. Penurunan tekanan uap larutan tersebut adalah… Diketahui: T = 25 0C. P0 = 23,76 mmHg. V = 900 mL. Mr = 60 g/mol. P = 22,84 mmHg.

Hitung Tekanan Uap Larutan Glukosa YouTube
Tentukan penurunan tekanan uap jenuh larutan 10% massa glukosa (C6H12O6) dalam air, jika diketahui tekanan uap air pada suhu 25 C adalah 24 mmHg!. fraksi mol terlarut dikali tekanan uap jenuh murni 0,009 * 24 mmhg yang kita ketahui dari soal hasil nya adalah 0,237 mmhg penurunan tekanan uap jenuh larutan tersebut adalah 0,237 mmhg sekian.

Penurunan tekanan uap suatu larutan yang terdiri atas cam...
Masukkan konstanta-konstanta Anda. Persamaan Clausius-Clapeyron memiliki dua konstanta: R dan ΔH uap.R selalu sama dengan 8,314 J/(K × Mol). Akan tetapi, ΔH uap (entalpi penguapan) bergantung pada zat yang tekanan uapnya Anda cari. Seperti yang dituliskan di atas, Anda biasanya dapat mencari nilai-nilai ΔH uap untuk berbagai macam zat di bagian belakang buku paket kimia atau fisika, atau.

Tekanan uap pada temperatur 30 adalah 55.30 mmHg . Maka
March, the first month of the spring in Tucson, is a pleasant month, with an average temperature fluctuating between 71.8°F (22.1°C) and 50.7°F (10.4°C). Tucson's weather in March presents a minor rise in the average high-temperature, moving from a comfortable 64°F (17.8°C) in February to an agreeable 71.8°F (22.1°C).

Tekanan uap air jenuh pada suhu 30 C adalah 31,8 mmHg dan...
Tekanan uap jenuh air murni pada suhu 20 °C sebesar 17,5 mmHg. Tentukan tekanan uap jenuh larutan pada suhu tertentu! Jawab: xB = 0,2 P° = 17,5 mmHg ΔP = P° ⋅ XB = 17,5 mmHg × 0,2 = 3,5 mmHg P = P° - ΔP = 17,5 - 3,5 = 14 mmHg 3. Tentukan penurunan tekanan uap jenuh larutan 10% massa glukosa (C6H12O6) dalam air, jika diketahui.

SOLUTION 2 penurunan tekanan uap larutan Studypool
fraksi mol glukosa = 0.25/ (0.25 + 5) = 0.048. Penurunan tekanan uap jenuh air: ΔP = P o . Xt = 18 x 0.048 = 0.864 mmHg. *Catatan: Zat yang mudah menguap adalah senyawa organik ( misalnya alkohol, eter, parfum dsb), yang merupakan senyawa nonelektrolit sehingga rumusan ∆P hanya untuk nonelektrolit.

Jika Diketahui Tekanan Osmotik Larutan 10
Halo konferensi nada soal diketahui tekanan uap air pada 100 derajat Celcius itu adalah 760 mm HG kemudian yang berapa tekanan uap larutan ph untuk larutan glukosa 18% pada suhu yang sama ini menggunakan konsep dari sifat koligatif yang sifat koligatif larutan itu adalah sifat larutan yang tidak bergantung pada jenis zat terlarut Tetapi hanya bergantung pada konsentrasi partikel zat terlarut.
Contoh Soal Penurunan Tekanan Uap Homecare24
P = P 0 - ∆P = 17,5 - 3,5 = 14 mmHg. Soal No. 5. Tentukan penurunan tekanan uap jenuh larutan 10% massa glukosa (C 6 H 12 O 6) dalam air, jika diketahui tekanan uap air pada suhu 25 0 C adalah 24 mmHg! Pembahasan: Diketahui: gr glukosa = 10% = 10/100 x 100 gr = 10 gr. n glukosa = 10/180 = 0,055 mol. gr air = massa total - massa glukosa.

Animasi Sifat Koligatif Larutan Penurunan Tekanan Uap Free download cek deksripsi YouTube
Pembahasan. Cara menjawab soal ini sebagai berikut: ΔP = P o - P. P = 23,76 mmHg - 22,84 mmHg = 0,92 mmHg. Jadi penurunan tekanan uap larutan sebesar 0,92 mmHg. Contoh soal 2. Hitunglah tekanan uap larutan 2 mol glukosa dalam 50 mol air pada suhu 300 °C jika tekanan uap air murni pada 300 °C adalah 31,80 mmHg. Pembahasan.
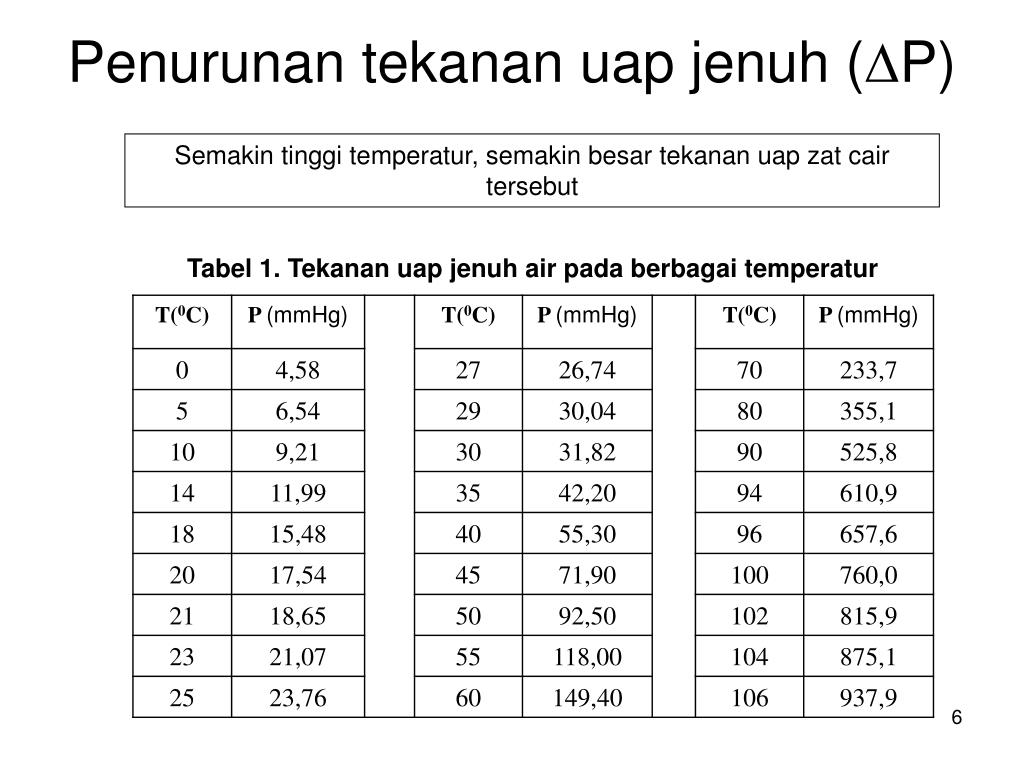
Tabel Tekanan Uap Air tekenenmay
6. Tekanan uap jenuh air pada suhu 100 o C adalah 760 mmHg. Berapakah tekanan uap jenuh larutan glukosa 10% pada suhu 100 o C (H = 1; C = 12; O = 16 ) Jawab : Tekanan uap jenuh larutan sebanding dengan fraksi mol pelarut. Dalam 100 gram larutan terdapat : Air 90% = 90 gram = 90/18 mol = 5 mol. Glukosa 10% = 10 gram = 10/180 mol = 0.056 mol
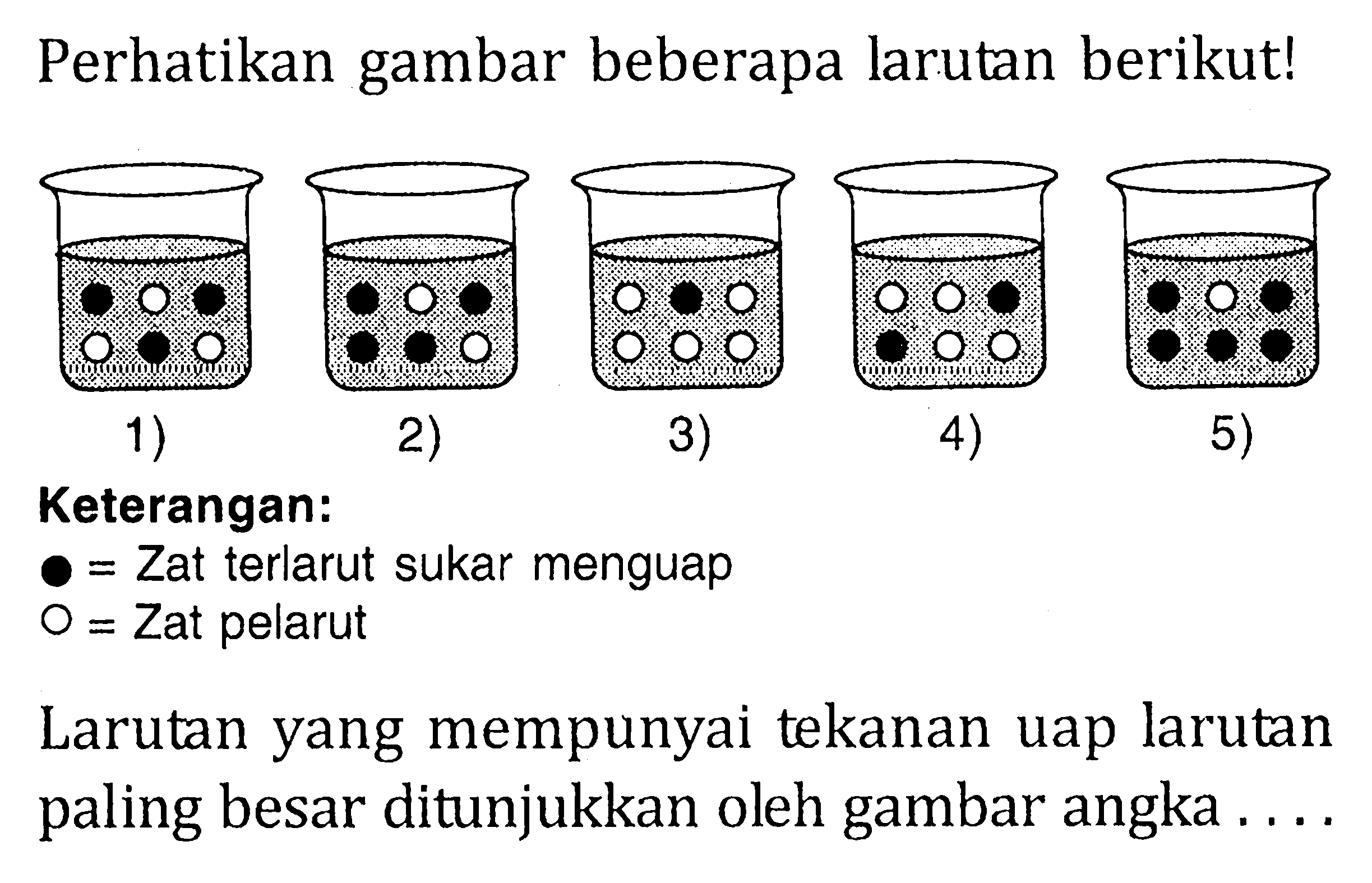
Penurunan tekanan uap larutan disebabkan oleh
Sifat koligatif larutan meliputi empat hal, yaitu penurunan tekanan uap (∆P), kenaikan titik didih (∆Tb), penurunan titik beku (∆Tf), dan tekanan osmotik (π). Penurunan tekanan uap merupakan selisih antara tekanan uap pelarut murni dengan tekanan uap pelarut dalam larutan. Rumus persamaannya adalah: ΔP = Xt x Pᵒ