
Bilangan kuantum Utama, Azimut, dan Spin YouTube
Keempat bilangan tersebut digunakan untuk menunjukkan letak elektron terakhir (terluar) dari suatu atom. Dimulai dari letak kulit atom (utama), subkulit atom (azimut), letak orbital (magnetik) hingga perputaran elektronnya (spin).. Bilangan Kuantum Spin(s) Nilai = +1/2 dan -1/2 Kegunaan = Menyatakan arah perputaran elektron Jika arah.

Konsep Bilangan Kuantum, Cara Memahami dan menyusunnya Sains Pedia
Bilangan kuantum spin. Bilangan kuantum spin adalah bilangan kuantum keempat yang dilambangkan dengan ms atau s. Disadur dari Thought Co, bilangan kuantum spin menunjukkan orientasi momentum sudut intrinsik elektron dalam atom. Bilangan kuantum spin ditemukan oleh Otto Stern dan Walter Gerlach melalui eksperimennya pada tahun 1920.

Cara Mencari 4 Bilangan Kuantum
Yuk, belajar cara mencari bilangan kuantum dengan mudah melalui artikel Kimia kelas X berikut ini! —. Sadar nggak sih, kalau dunia kita ini penuh sekali akan berbagai hal yang teratur dengan rapi. Mulai dari matahari yang terbit dari arah Timur hingga terbenam ke arah Barat. Kemudian, ada bumi yang mengelilingi matahari dalam dua belas bulan.

Kimia bilangan kuantum utama, azimut, dan spin YouTube
Bilangan kuantum spin (m s) mendeskripsikan arah spin elektron dalam orbital. Nilai m s yang diperbolehkan adalah +½ atau −½. Kombinasi bilangan kuantum n, l, dan m l yang mungkin pada 4 kulit elektron pertama dapat dilihat pada tabel berikut: Bentuk Orbital Atom Orbital s.

journal of dhamar [STRUKTUR ATOM] Bilangan Kuantum dan Bentuk Orbital
Bilangan kuantum spin tidak berkaitan dengan bilangan-bilangan kuantum sebelumnya. Bilangan kuantum spin menunjukkan arah perputaran elektron terhadap inti atom (rotasi). Ada dua kemungkinan arah rotasi elektron yaitu searah jarum jam dan berlawanan arah dengan jarum jam. Sehingga nilai dari bilangan kuantum spin ini adalah s = +1/2 (searah.

Bilangan Kuantum Spin Apa Itu? Simak Penjelasannya Berikut Ini!
KOMPAS.com - Dalam pelajaran unsur kimia, terdapat sub-bab tentang bilangan kuantum. Hal tersebut terangkum dalam tulisan berikut: Tentukanlah bilangan kuantum elektron terakhir dari unsur-unsur dibawah ini: a. 17Cl b. 26Fe c. 27Co d. 28Ni e. 31Ga f. 35Br. Jawaban: a. Tentukan konfigurasi atom klorin untuk menentukan bilangan kuantum elektron.

bilangan kuantum ada 4 jenis yaitu...
Bilangan kuantum utama menyatakan tingkat energi utama elektron suatu atom atau menunjukkan kulit atom. Kalau Sobat Zenius ingat model atom Bohr, bilangan dengan lambang "n" ini melambangkan kulit atomnya, nih. Nah, Sobat Zenius, gue punya rekomendasi video materi singkat yang ngebahas soal bilangan kuantum utama, nih.

Cara Membuat Keempat Bilangan Kuantum Dari Suatu Unsur Panduan Kimia + Riset
Bilangan kuantum menggambarkan sifat elektron dalam orbital. [1] Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum. [2] Bilangan kuantum merupakan salah satu ciri khas dari model atom mekanika kuantum.

Cara Menentukan Bilangan Kuantum Elektron Terakhir dari Unsur Besi (26Fe) Mekanika Kuantum
Bilangan kuantum azimuth dapat menunjukkan subkulit s, p, d, atau f yang ditempati oleh elektron.. Bilangan kuantum spin merupakan satu satunya bilangan kuantum yang tidak tergantung dari ketiga bilangan kuantum yang lain. Nilai kuantum spin memberikan penjelasan mengenai arah perputaran elektron dan dituliskan dengan simbol ms. Nilai.
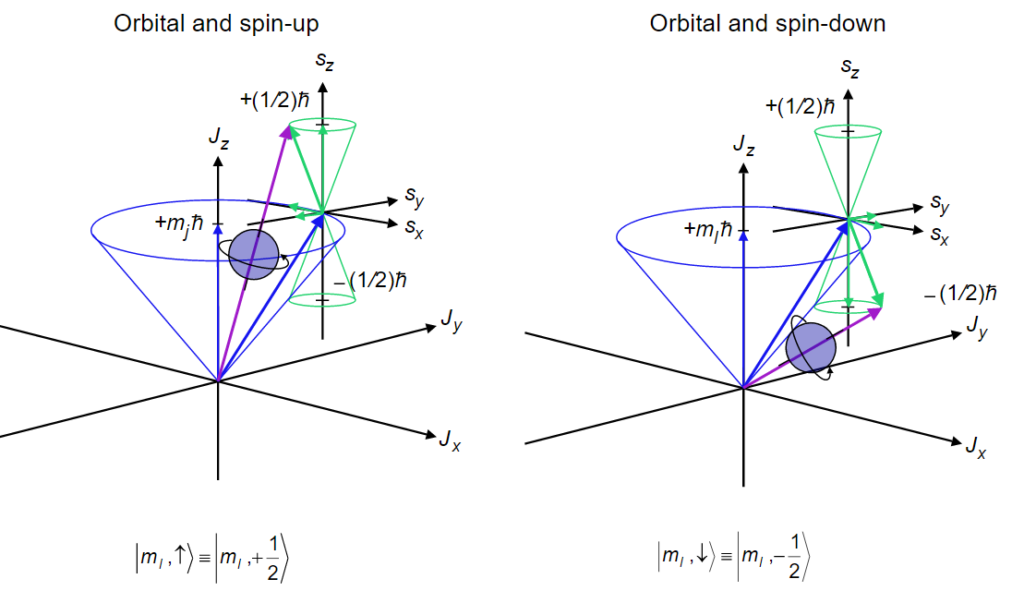
Diagram Bilangan Kuantum Spin MateriKimia
4. Bilangan Kuantum Spin (s) Bilangan kuantum spin (s) ini menunjukan arah perputaran (spin) atau rotasi di sebuah elektron pada sumbunya. Arahnya bisa searah jarum jam ataupun berlawanan dengan arah jarum jam. Untuk itu bilangan kuantum spin (s) ini diberi nama ± 1/2 atau -1/2. Perhatikan gambar dibawah terlebih dahulu berikut :
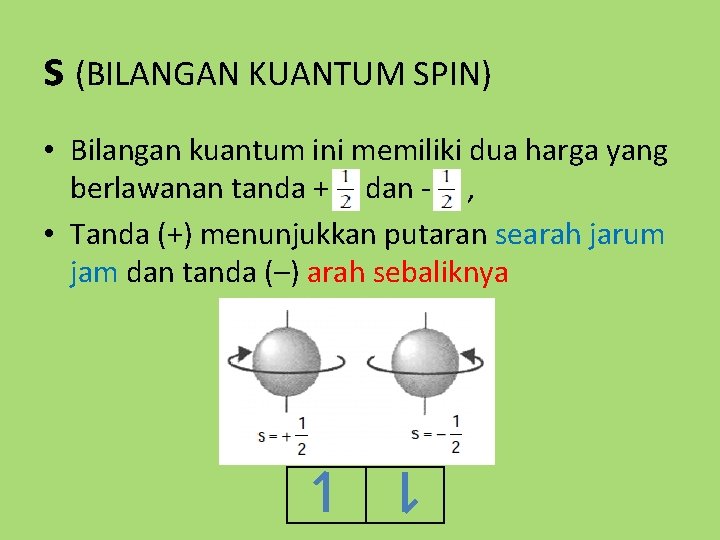
TEORI ATOM 2 BILANGAN KUANTUM APA YANG DIMAKSUD
Atom Berelektron Banyak - Bilangan Kuantum Utama, Orbital, Magnetik dan Kuantum Spin. Setelah kita bahas tentang perkembangan teori atom, disebutkan bahwa teori atom mengalami perkembangan yang pesat, dari hasil percobaan menunjukkan bahwa atom masih terdiri dari partikel - partikel yang lebih kecil yaitu proton, neutron dan elektron. kali.

Kimia kelas 10 bilangan kuantum utama, azimut, dan spin YouTube
Dimana bilangan kuantum spin akan dilambangkan dengan +1/2 dan -1/2. Ketika hasilnya positif, maka elektron akan memiliki arah ke putaran arah dan jika hasilnya negatif, maka elektron akan memiliki arah putaran ke bawah. Materi fisika kuantum akan terdiri dari berbagai macam sub topik pembahasan. Dalam pembahasan tersebut tentunya akan ada soal.

PPT Struktur Atom PowerPoint Presentation, free download ID3882274
Dalam fisika atom, bilangan kuantum spin adalah bilangan kuantum yang menentukan momentum sudut intrinsik (atau momentum sudut spin,. Istilah simbol suatu keadaan atomik menunjukkan nilai-nilai L, S, dan J-nya. Lihat juga. Bilangan kuantum momentum sudut total; Spektroskopi rotasional; Mekanika kuantum dasar.

Cara Mudah‼️Menentukan Bilangan Kuantum (Utama, Azimut, Spin) YouTube
Bilangan Kuantum Spin; Bilangan kuantum spin menyatakan spin elektron yang ada pada sebuah atom, bilangan ini disimbolkan dengan huruf 's'. Bilangan kuantum ini menunjukkan arah perputaran atau rotasi pada sebuah elektron terhadap sumbunya. Arah perputaran dapat searah dengan jarum jam ataupun berlawanan dengan arah jarum jam.

Bilangan Kuantum Adalah Media Belajar Online
Apabila sebuah bil. kuantum memiliki bilangan spin +1/2 maka elektronnya memiliki orientasi spin up. Dibawah ini adalah contoh tabel bilangan kuantum agar kalian lebih memahami tentang bil. kuantum.. Anak panah pada gambar di atas menunjukkan orbital atau ruang yang mungkin ditempati oleh sebuah elektron.

Kimia Kelas 10 Bilangan Kuantum Spin Bit CDN
Bilangan Kuantum Spin dan Pengertiannya Menurut model mekanika kuantum, atom terdiri dari inti yang terdiri dari proton dan neutron, di sekelilingnya terdapat elektron yang mengorbit dalam kulitnya. Setiap elektron memiliki kulit dan subkulitnya sendiri yang menunjukkan tingkat energinya.