
Biloks H Studyhelp
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.
B.Braun NaCl Oplossing voor injectie 0,9 1x100ml Flacon Glas Apotheek Peeters Oudsbergen
Biloks atau bilangan oksidasi merupakan kata yang biasanya ditemui dalam pelajaran kimia. Atom memiliki muatan negatif serta positif.. Biloks pada golongan logam Ia, IIa, dan IIIa contohnya adalah biloks Na dalam NaCl (+1), MgSO2 (+2), dan Al2O3 (+3). 4. Biloks pada golongan transisi atau golongan B lebih dari satu. Contohnya adalah biloks.

Cara Menentukan Biloks Berdasarkan Prioritas YouTube
Dalam mata pelajaran Kimia juga ada bilangan yang disebut bilangan oksidasi atau dikenal juga dengan nama biloks.. Senyawa NaCl; Pada senyawa NaCl, jumlah bilangan oksidasi Na dan Cl harus sama dengan nol. Adapun bilangan oksidasi Na dalam NaCl adalah +1, sedangkan bilangan oksidasi Cl dalam NaCl adalah -1 sehingga jumlah kedua bilangan.

Aturan Penentuan Bilangan Oksidasi (Biloks) Chemistry Castel
Biloks H = +1. Atom H memiliki indeks 4, maka biloks H dikalikan dengan indeks H = +4. Karena jumlah muatan NH₄+ = +1, maka biloks N haruslah -3, agar ketika biloks N dan H dijumlahkan, hasilnya sesuai dengan jumlah muatannya, yaitu +1. 8. Bilangan oksidasi oksigen (O) dalam senyawa peroksida = -1. Bilangan oksidasi O dalam senyawa non.
Mini Plasco Nacl 0,9 Amp20x20ml Apotheek Bouckaert
Di artikel ini gue akan membahas lebih dalam tentang cara menentukan bilangan oksidasi hingga aturan biloks beserta contoh soalnya. Sebelumnya, elo udah belajar tentang cara menentukan reaksi redoks dan oksidasi.. Biloks Na dalam NaCl adalah.. a. 0. b. +1. c. -1. d. +2. e. -2. Jawab: b. +1. Pembahasan: NaCl, keduanya sama-sama memiliki.
Nacl crystal lattice hires stock photography and images Alamy
Jawaban: Biloks total NaCl = 0; biloks Na adalah +1; biloks Cl adalah -1 Bilangan oksidasi (biloks) didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron.

Biloks & Penyetaraan Reaksi Redoks Metode Setengah Reaksi Reaksi Redoks Kimia Kelas 12 YouTube
Dalam menentukan bilangan oksidasi (biloks) kita juga harus mengikuti aturan-aturan bilangan oksidasi yang telah ditetapkan oleh. Skip to the content.. IIA, dan IIIA dalam senyawanya sesuai dengan nomor golongannya. Contohnya, bilangan oksidasi Na dalam senyawa NaCl = +1, bilangan oksidasi Mg dalam senyawa MgCl 2 = +2, dan bilangan oksidasi.
(B) B. Braun NaCl 0.9 soluzione ecoflac 395202 1000ml Medikamente Smart Dentist AG
Reaksi reduksi adalah reaksi yang terjadi penurunan bilangan oksidasi. Oleh karena itu, perlu diketahui biloks unsur pada setiap senyawanya. Perlu diketahui bahwa unsur bebas memiliki biloks 0, sehingga unsur pada dan unsur pada memiliki biloks 0. Selain itu, perlu diketahui bahwa unsur golongan IA pada suatu senyawa pasti memiliki biloks sebesar +1, sehingga unsur pada memiliki biloks sebesar +1.

Structure of Sodium Chloride (NaCl) Formation of NaCl How to draw NaCl Structure Ionic
Enter the formula of a chemical compound to find the oxidation number of each element. A net ionic charge can be specified at the end of the compound between { and }. For example: ZnCl4 {2-} or NH2NH3 {+}. Enter just an element symbol to show the common and uncommon oxidation states of the element. Use uppercase for the first character in the.
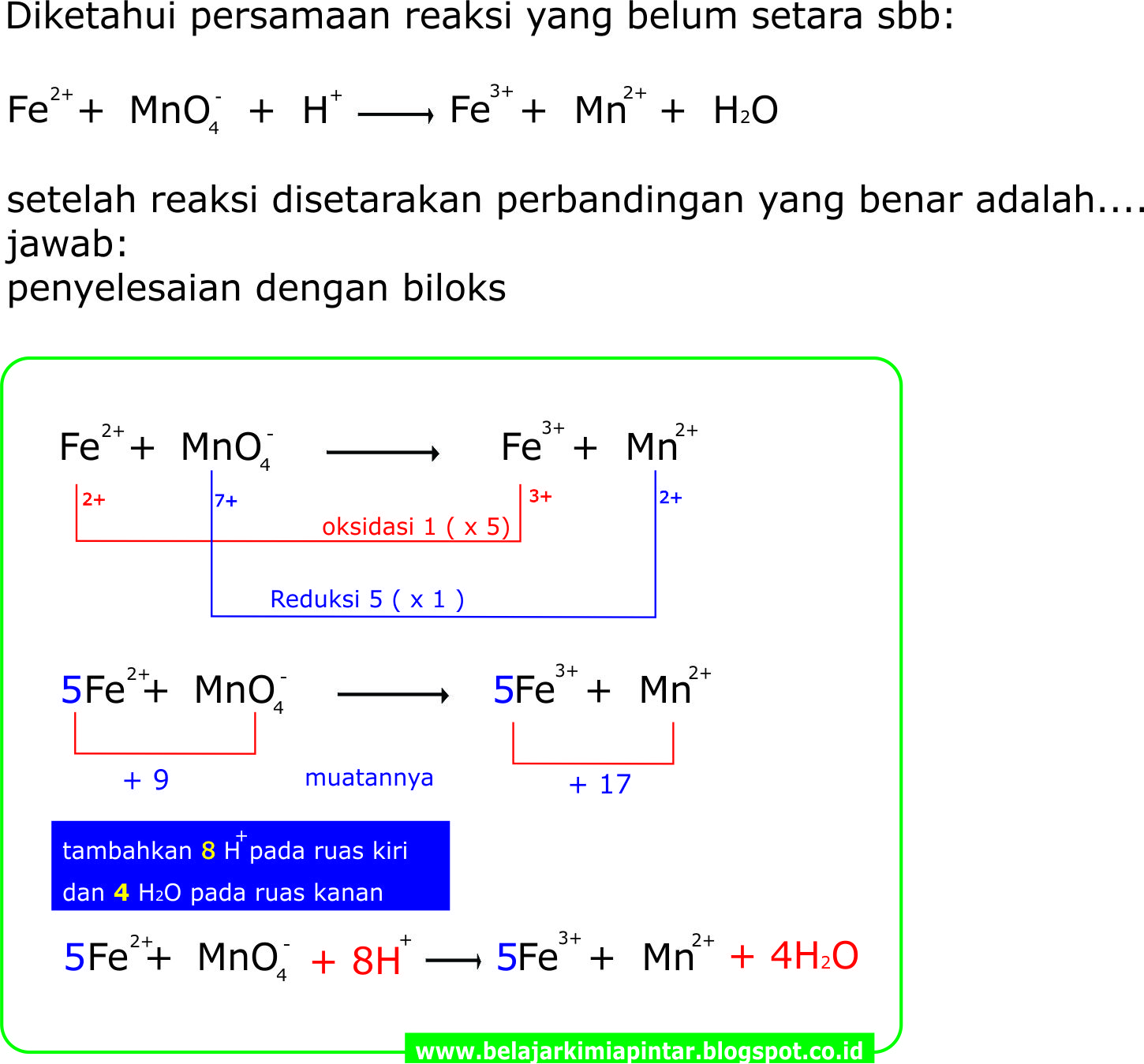
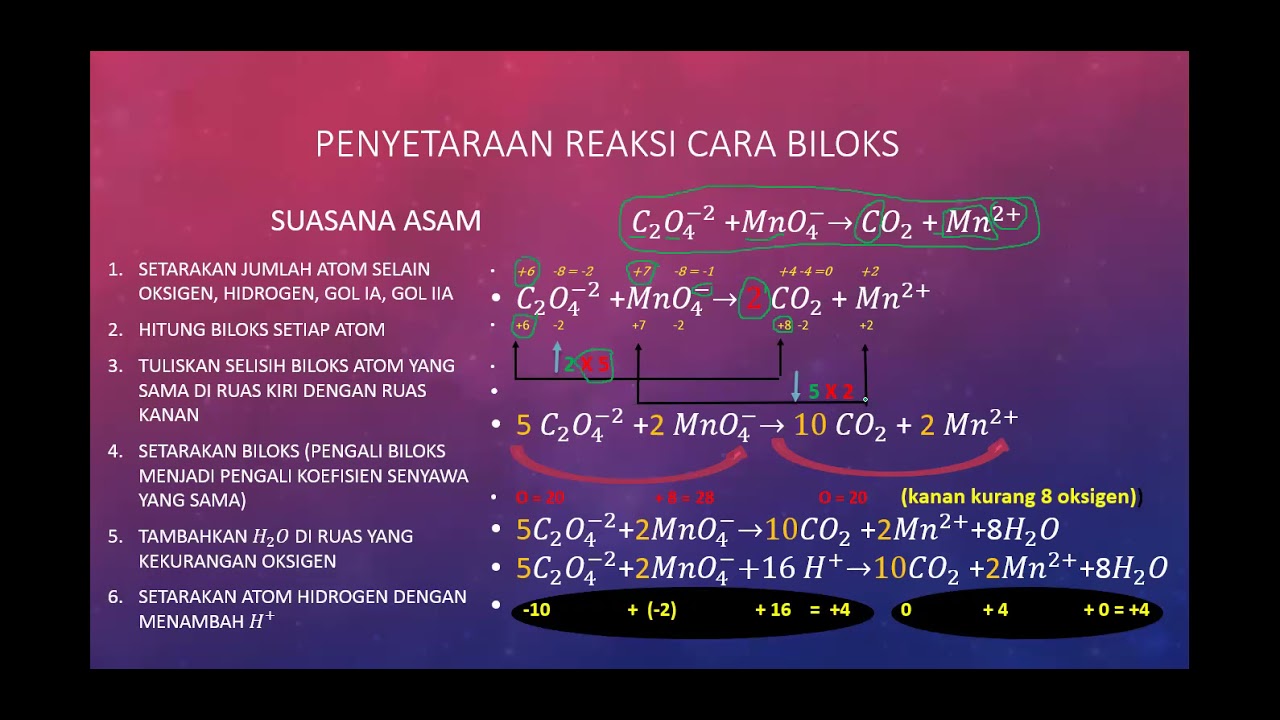
TRIK PENYETARAAN REAKSI REDOKS CARA BILOKS (SUASANA ASAM) KIMIA OKE PINTAR
Bilangan oksidasi. Dalam kimia, bilangan oksidasi, biloks, atau keadaan oksidasi, adalah muatan hipotesis sebuah atom jika semua ikatannya dengan atom yang berbeda sepenuhnya ionik. Bilangan ini menggambarkan tingkat oksidasi (kehilangan elektron) dari sebuah atom dalam senyawa kimia. Secara konseptual, bilangan oksidasi dapat berupa bilangan.
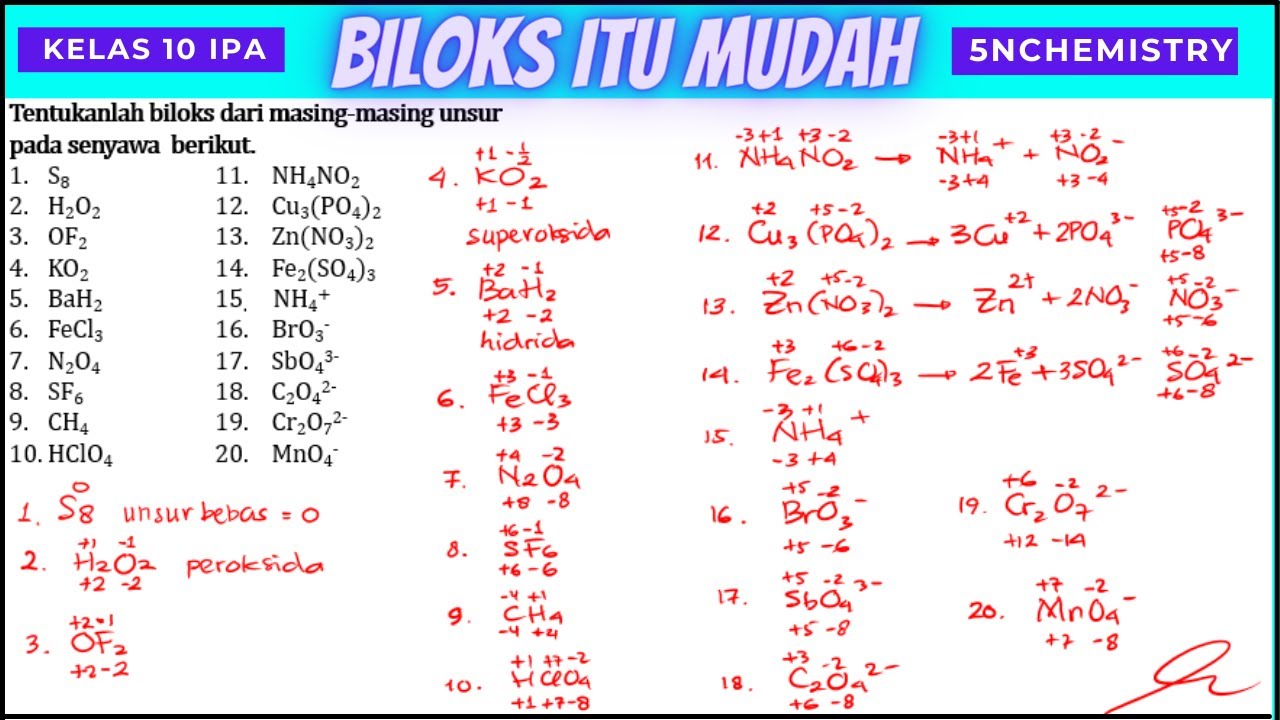
LENGKAP ‼️MENENTUKAN BILOKS UNSUR DALAM SENYAWA YouTube
Berdasarkan persamaan reaksi di atas, spesi NaClO mengalami reaksi reduksi sekaligus oksidasi. Hasil reduksinya adalah NaCl karena terjadi penurunan biloks Cl dari +1 (NaClO) menjadi -1 (NaCl). Sedangkan hasil oksidasinya adalah NaClO 3 karena terjadi penambahan biloks Cl dari +1 (NaClO) menjadi +5 (NaClO 3). Penyetaraan Persamaan Reaksi Redoks

biloks Cu biloks kimia kelas X YouTube
Biloks atau bilangan oksidasi adalah bilangan menunjukkan sumbangan muatan atom unsur pada molekul atau ion yang dibentuknya. Berikut cara menentukan biloks dan contoh soalnya.. sedangkan yang menangkap elektron bertanda negatif. Misalnya, pada senyawa NaCl, atom Na melepaskan 1 elektron kepada atom Cl sehingga bilangan oksidasi Na adalah +1.

PENYETARAAN REAKSI REDOKS DENGAN CARA BILOKS UNTUK REAKSI MOLEKUL (Part 2) YouTube
Bilangan oksidasi unsur Cl pada NaCl, KCl, MgCl 2, dan FeCl 3 adalah -1. 5. Bilangan oksidasi unsur H pada senyawanya adalah +1.' Kecuali dalam hidrida (senyawa hydrogen dengan logam), bilangan oksidasinya -1′. Biloks dari ion seperti hidrida adalah sama dengan muatan ion, dalam hal ini adalah -1..
PENYETARAAN REAKSI REDOKS CARA BILOKS YouTube
Contohnya pada senyawa NaCl, bilangan oksidasi Na adalah +1 dan bilangan oksidasi Cl adalah -1. Aturan Bilangan Oksidasi (Biloks) Berikut aturan standar yang belaku dalam penentuan bilangan oksidasi. 1. Biloks Unsur Bebas adalah = 0. Biloks Logam Gol IA (Li, Na, K, Rb, Cs, Fr) dalam Senyawa = +1

Illustration Nacl Molecule Salt ilustración de stock 37738018
Contoh, dalam senyawa ion NaCl biloks Cl bernilai -1, karena keelektronegatifan Na < Cl. Demikian juga Cl dalam senyawa kovalen (molekul) HCl biloks Cl -1, karena keelektronegatifan H < Cl. Tetapi dalam HClO biloks Cl bernilai +1, sama dengan biloksnya H +1, karena keelektronegatifan Cl < O. Tentang perbandingan (lebih besar dan lebih kecil.

Aturan Biloks Kls X PDF
Contoh: Bilangan oksidasi Na dalam senyawa NaCl adalah +1. Biloks golongan logam IIA = +2. IIA = Be, Mg, Ca, Sr, Ba, Ra = +2.. Ingat aturan biloks poin 6, jumlah biloks unsur-unsur yang membentuk senyawa = 0. Jadi, apabila biloks Al dan H dijumlahkan, hasilnya harus 0. Agar biloks Al + biloks H = 0, biloks H haruslah -3.