
PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Untuk larutan asam, pH-nya ini berada di angka 7 yang dibuat dari asam lemah seperti CH₃C00H, HCN, H₂C0₃, dan ditambahkan basa konjugasi. Jadi, meskipun namanya larutan asam, tapi tetap nih ada sifat basanya juga. Larutan Penyangga Basa. Nah, kalau untuk larutan basa, harus ada campuran antara basa lemah seperti NH₃ dan asam konjugasinya.

Kimia Dasar Buffer Asam (Bagian 2) YouTube
Buffering Capacity. doi: 10.1159/000489513. PMID: 10.1159/000489513. Abstract. Each biological system possesses a widely unrecognized buffer system to maintain acid-base balance to a specific pH. Our lives are dependent on the functioning of buffer systems. A buffer system is a solution that resists a change in pH when acids or bases are added.
√ Larutan Penyangga / Buffer Pengertian, Rumus, dan Contoh Soal
Pada sistem buffer ini H2PO4- bertindak sebagai asam dan HPO4- bertindak sebagai konjugat atau garamnya. Jika larutan ini ditambahi asam [H+] maka ion H+ akan bereaksi dengan ion HPO42- (larutan buffer dalam suasana asam) H+ + HPO42- → H2PO4- Kesetimbangan akan bergeser ke kiri, sehingga konsentrasi ion H+ dapat dipertahankan.

Penyangga Buffer Asam Asetat dan Natrium Asetat YouTube
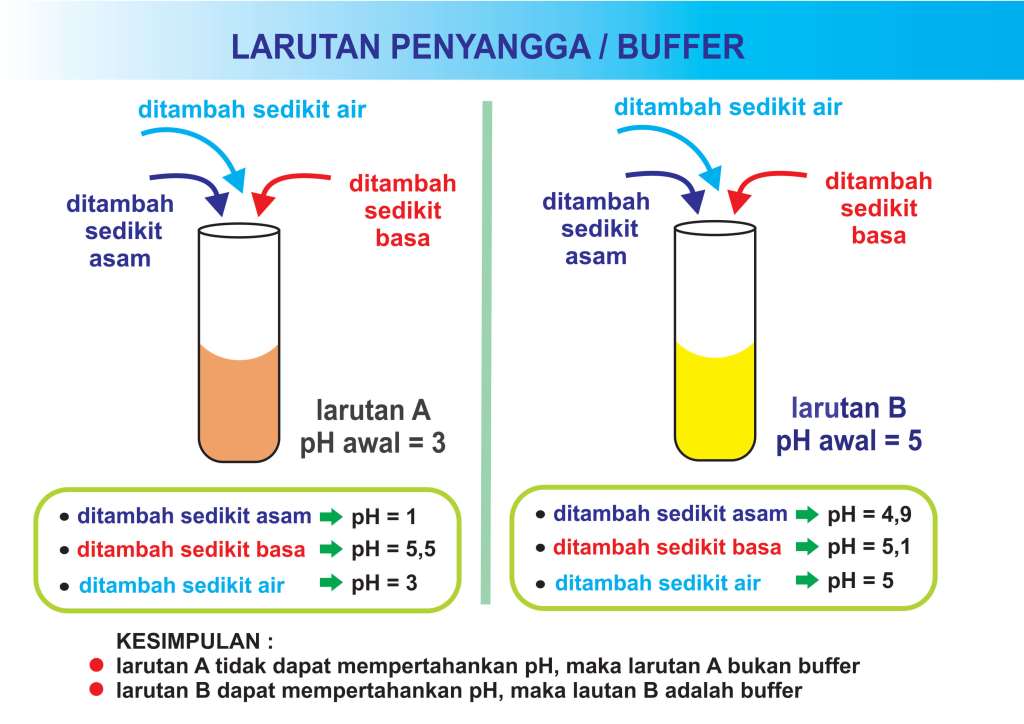
TM dan laporan praktikum Kimia Dasar - materi buffer. Larutan penyangga atau sering disebut larutan buffer adalah larutan yang dapat mempertahankan pH pada kisarannya apabila terdapat upaya untuk menaikkan atau menurunkan pH, melalui penambahan air/asam/basa dalam jumlah yang besar. Larutan penyangga memiliki dua komponen yaitu asam dan basa.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Larutan penyangga adalah larutan yang mampu mempertahankan derajat keasaman (pH) pada saat asam atau basa dimasukkan dalam suatu larutan. Larutan penyangga disebut juga "buffer" atau "penahan". Berikut ini yang termasuk dalam larutan buffer. 1. Campuran asam lemah dengan garam yang berasal dari asam lemah tersebut. Contoh : CH 3 COOH.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Bookshelf ID: NBK507807 PMID: 29939584. To maintain homeostasis, the human body employs many physiological adaptations. One of these is maintaining an acid-base balance. In the absence of pathological states, the pH of the human body ranges between 7.35 to 7.45, with the average at 7.40.

Sistem Buffer Asam Basa PDF
Buffer juga dapat disebut buffer pH, buffer ion hidrogen, atau larutan buffer. Buffer digunakan untuk mempertahankan pH yang stabil dalam larutan, karena dapat menetralkan sejumlah kecil asam basa tambahan. Untuk larutan buffer yang diberikan, terdapat rentang pH kerja dan sejumlah asam atau basa tertentu yang dapat dinetralkan sebelum pH berubah.

Cara Kerja Larutan Penyangga Asam dan Basa Kimia SMA Kelas 11 Materi
Larutan dapar atau Larutan penyangga (lebih tepatnya, dapar pH atau dapar ion hidrogen) (Inggris: buffer solution, pH buffer, hydrogen ion buffer ) adalah larutan yang mengandung campuran asam lemah dan basa konjugatnya, atau sebaliknya. Perubahan pH larutan ini sangat kecil, ketika asam atau basa kuat ditambahkan, dalam jumlah sedikit atau.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Larutan buffer asam atau larutan penyangga asam bertugas mempertahankan pH dalam kondisi asam yakni pH<7. Larutan penyangga asam tersusun dari komponen basa konjugasi (A-) dan asam lemah (HA). Larutan penyangga basa bisa diperoleh melalui: Mencampurkan HA atau asam lemah dan garam basa konjugasinya LA dimana bisa terionisasi dan menghasilkan.
PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Maka kapasitas buffer yang dimiliki ini termasuk kecil. penambahan basa atau asam pada suatu larutan buffer memang dapat mengubah nilai pH-nya. Namun perubahan itu tidak begitu besar dan bisa diabaikan. Akan tetapi apabila jumlah asam maupun basa yang ditambahkan semakin banyak, maka perubahan pH yang terjadi tidak boleh diabaikan.

Buffers Contoh Soal Kumpulan Contoh Soal
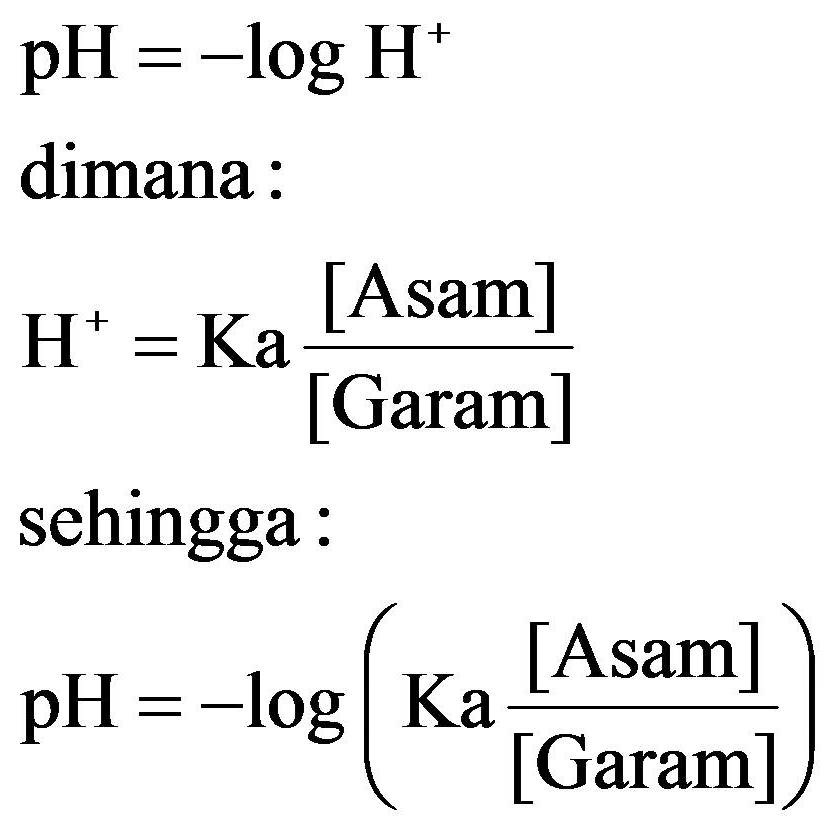
Rumus Buffer Asam Lemah Basa Lemah - Kali ini kami akan berbagi materi kimia yang berkenaan dengan rumus Buffer asam lemah dan basa lemah. Tahukah sahabat bahwa istilah Buffer memiliki makna yang sama dengan Larutan Penyangga dalam kimia atau kadang juga disebut dengan Larutan Dapar.

Larutan Penyangga (Larutan Buffer) AsamBasa dan Cara Memahami Rumusnya
Larutan buffer asam mempertahankan pH pada suasana asam (pH < 7). Larutan buffer asam terdiri dari komponen asam lemah (HA) dan basa konjugasinya (A−). Larutan seperti ini dapat diperoleh dengan: mencampurkan asam lemah (HA) dengan garam basa konjugasinya (LA, yang dapat terionisasi menghasilkan ion A−)

Kekuatan asam basa, Buffer, dan Kesetimbangan YouTube
Berdasarkan asam basa penyusunnya, larutan buffer dibedakan menjadi 2, yakni sebagai berikut : 1. Larutan buffer asam. Larutan buffer asam yaitu larutan penyangga yang terbentuk dari asam lemah dan basa konjugasinya. Larutan penyangga asam mempunyai pH kurang dari 7. Contoh: CH₃COOH (asam lemah) dan CH₃COO- (basa konjugasinya). 2.

Asam Basa [Buffer Asam Basa] CEK DESKRIPSI YouTube
Cara kedua ini harus menghasilkan sisa dari asam lemah atau basa lemah. Dari persamaan tersebut, CH 3 COOH (asam lemah) dan NH 3 (basa lemah) masih tersisa, sedangkan NaOH dan HCl habis bereaksi.. Jadi, garam yang terbentuk dari CH 3 COONa mengandung basa konjugasi. Sedangkan garam dari NH 4 Cl mengandung asam konjugasi.. Jenis-Jenis Larutan Buffer dan Cara Kerjanya

ASAMBASAGARAM p H buffer ASAM TEORI ASAM PROTON
BAB VI KESIMPULAN 6.1 Kesimpulan Buffer merupakan larutan yang cenderung mempertahankan pH nya, namun buffer sendiri memiliki kapasitas tertentu dimana jika ditambahkan sejumlah asam atau basa kuat akan merubah pH buffer itu sendiri. Semakin ditambah asam dan basanya, maka pH nya semakin berubah menurut tingkat pH pentitrasinya.
Cara Menghitung pH Larutan Asam, Basa, Garam Beserta Contoh Soal dan
Example 11.8.1. Which solute combinations can make a buffer solution? Assume all are aqueous solutions. HCHO 2 and NaCHO 2; HCl and NaCl; CH 3 NH 2 and CH 3 NH 3 Cl; NH 3 and NaOH; SOLUTION. Formic acid (HCHO 2) is a weak acid, while NaCHO 2 is the salt made from the anion of the weak acid—the formate ion (CHO 2 −).The combination of these two solutes would make a buffer solution.