
Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Dalam teori asam basa Bronsted Lowry tidak ada zat yang bersifat netral. Menurut Bronsted Lowry, setiap zat akan bersifat asam atau basa bergantung apakah ia menerima atau melepaskan proton ion (H + ). Selain itu, teori asam basa Bronsted Lowry bersifat luas, tidak hanya bergantung pada pelepasan ion H + atau OH +, misalnya senyawa NH 2-.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis
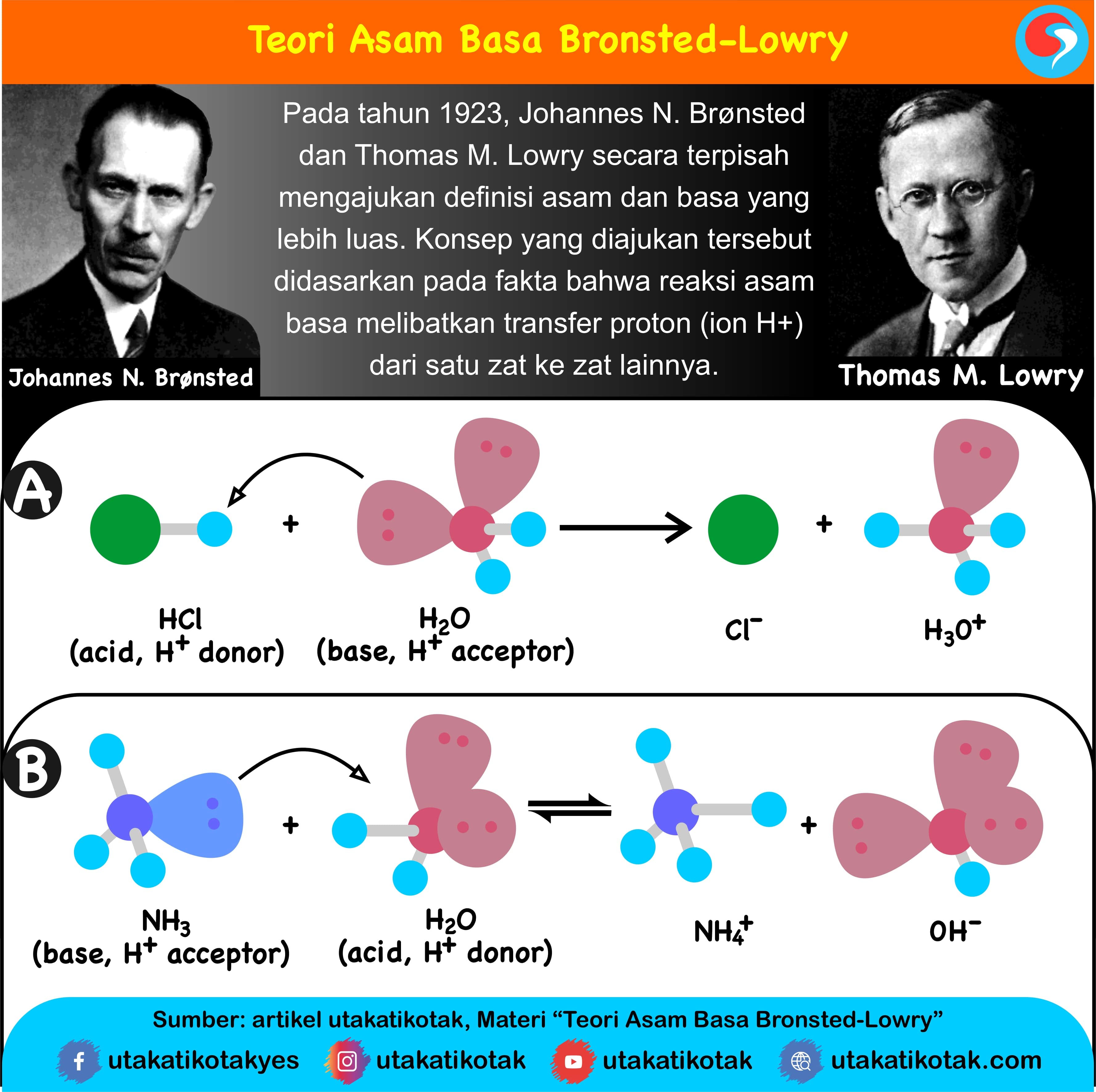
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh Riset
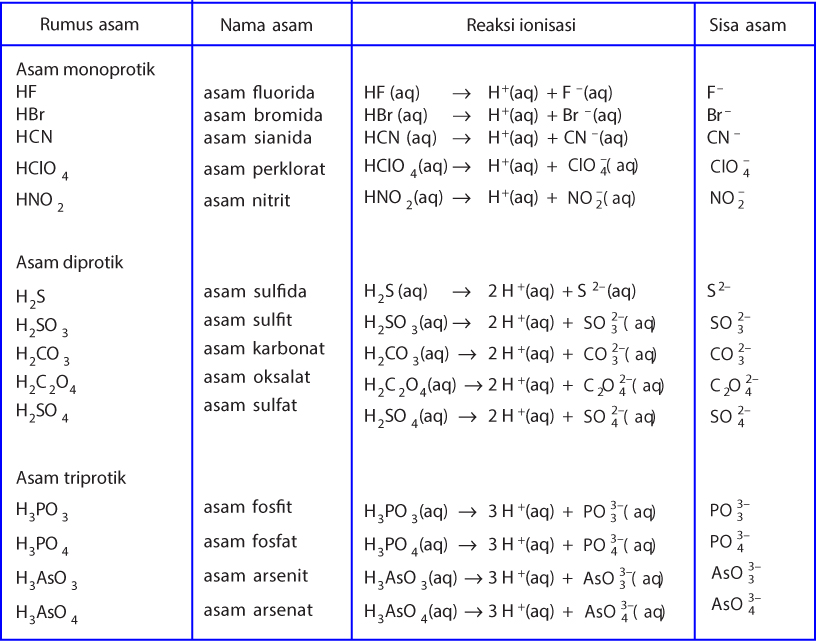
Contoh Asam dan Basa Menurut Teori Bronsted-Lowry Beberapa contoh asam yang umum dikenal dalam teori Bronsted-Lowry antara lain asam klorida (HCl), asam sulfat (H2SO4), dan asam asetat (CH3COOH). Sedangkan contoh basa meliputi amonia (NH3), natrium hidroksida (NaOH), dan kalium hidroksida (KOH).

Teori Asam Basa Bronsted Lowry Meteor
Contoh Mengidentifikasi Asam dan Basa Bronsted Lowry. Tidak seperti asam dan basa Arrehenius, pasangan asam basa Bronsted Lowry bisa terbentuk tanpa adanya reaksi di dalam larutan berair. Sebagai contoh, amonia dan juga hidrogen klorida bisa bereaksi membentuk amonium klorida padat menurut beberapa reaksi seperti berikut: NH3(g) + HCl(g) →.

Menentukan Asam Basa Konjugat BronstedLowry YouTube
Video berisi tentang cara menentukan pasangan asam basa konjugasi dari teori asam basa Bronsted-Lowry. Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semu.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Teori Asam Basa Menurut Bronsted-Lowry Bronsted-Lowry mendeskripsikan asam dan basa dengan jenis larutan yang bermacam-macam. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor proton), sedangkan basa menerima H+ (akseptor proton).. Contoh Soal Asam Basa dan Jawaban, Materi IPA Kelas 7. Materi Asam-Basa: Pengertian, Ciri-Ciri.

Mudah😆 !! Pasangan AsamBasa menurut Teori Bronsted Lowry YouTube
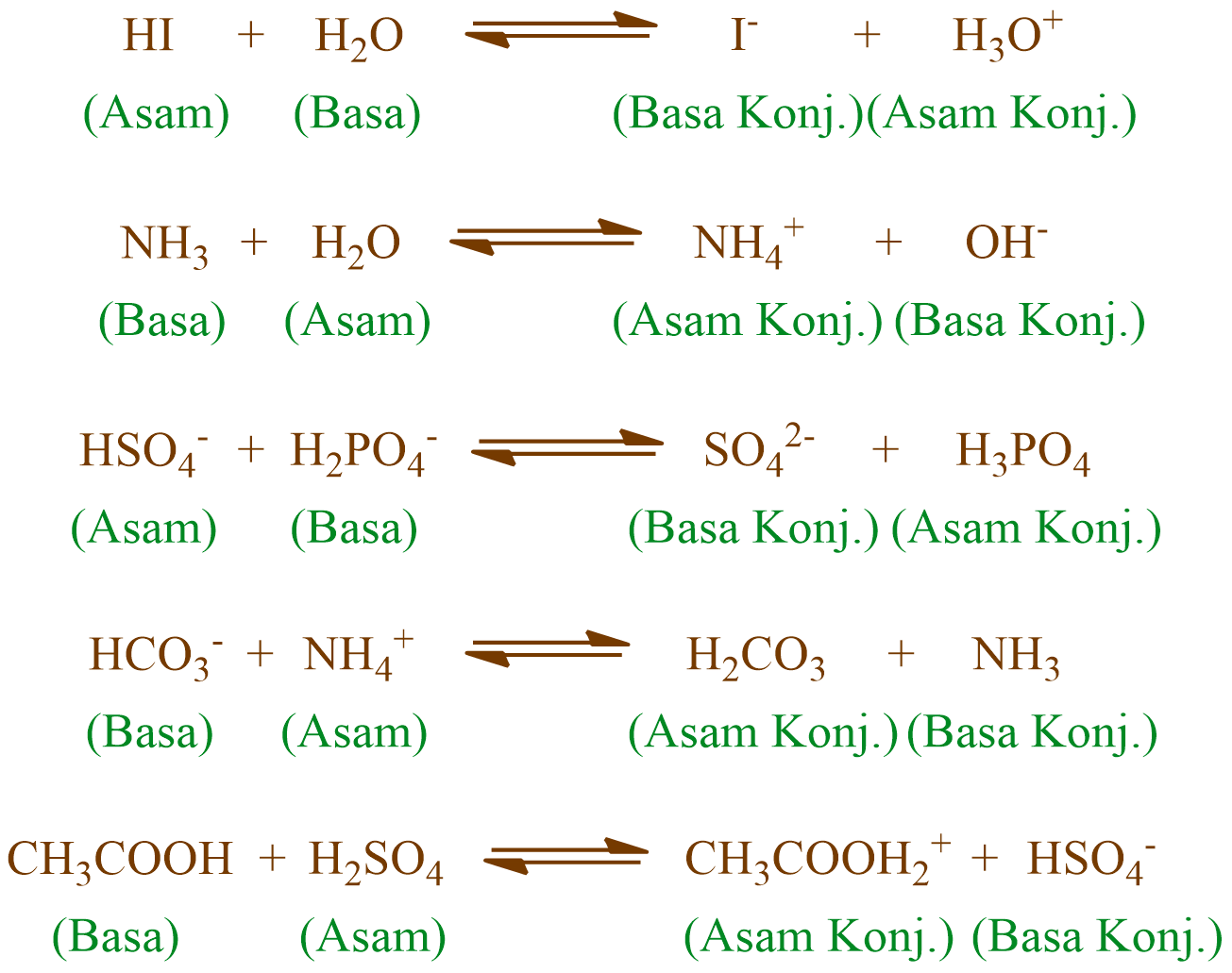
KOMPAS.com - Menurut teori Bronsted Lowry, asam adalah spesies yang dapat mendonorkan proton.Adapun, asam Bronsted memiliki pasangan basa konjugasinya. Berikut adalah contoh pasangan asam dan basa konjugasi Bronsted Lowry!. Dilansir dari Chemistry LibreTexts, basa konjugasi adalah asam yang telah mendonorkan atau kehilangan protonnya.. Artinya, asam melepaskan proton (H+) untuk mencapai.

Asam Basa Bronsted Lowry (Asam Basa Konjugasi) YouTube
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Teori Asam Basa Menurut Bronsted-Lowry merupakan konsep penting dalam kimia yang menjelaskan bagaimana reaksi asam-basa terjadi. Menurut teori ini, asam. Langsung ke isi. Kimia. Menu.. Sebutkan contoh asam yang dihasilkan dari basa konjugat NH4+. Asam konjugat dari NH4+ adalah asam amonium (NH4+).
Menurut Konsep Asam Basa Bronsted Lowry mari semua dansa denganku lirik
Teori Bronsted-Lewry disebut juga dengan pasangan asam-basa konjugasi. Menurut Lowry, asam dan basa hanya terionisasi di dalam air saja. Hal ini dikarenakan air bisa menarik ion H+ dan membentuk ion hidronium dan air melepas ion H- sehingga membentuk ion hidroksida. Baca juga: Jenis-Jenis Indikator Asam Basa.

Diketahui persamaan reaksi asam basa BronstedLowry berik...
Definisi asam dan basa. Johannes Nicolaus Brønsted dan Thomas Martin Lowry, secara terpisah, memformulasi ide bahwa asam adalah donor proton (H +) sementara basa adalah akseptor proton. Menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika terdisosiasi di dalam larutan akuatik membebaskan H+ (ion hidrogen).

Kimia Sma Asam Basa Bronsted Lowry Menentukan Asam Atau Basa Suatu Sexiz Pix
Tetapi, tidak seluruh basa Bronsted Lowry adalah basa dari Arrhenius. Berikut beberapa contoh dari reaksi asam basa dengan pelarut lain selain air pada fase gas. Salah satu contohnya adalah reaksi yang terjadi antara HCl dan NH3. Pada contoh di atas dapat dilihat bahwa reaksi asam basa Bronsted Lowry ada dua pasangan asam basa.
Teori Asam dan Basa Menurut BronstedLowry
Sains. Diperbarui pada 01 Maret 2019. Teori asam-basa Brønsted-Lowry (atau teori Bronsted Lowry) mengidentifikasi asam dan basa kuat dan lemah berdasarkan apakah spesies menerima atau menyumbangkan proton atau H + . Menurut teori, asam dan basa bereaksi satu sama lain, menyebabkan asam membentuk basa konjugasinya dan basa membentuk asam.

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh
Contoh asam menurut Arrhenius adalah asam klorida (HCl), asam sulfat (H2SO4), asam nitrat (HNO3), dan lain-lain. Semua asam ini jika dilarutkan dalam air akan melepaskan ion H+.. Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923. Menurut.

Teori Asam Basa Bronsted Lowry
Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya.. Contoh asam menurut Arrhenius adalah senyawa HCl yang apabila dilarutkan dalam air akan terionisasi menjadi: HCl (g) + H 2 O (l) → Cl-(aq) + H 3 O+ (aq)

Perhatikan Reaksi Asam Basa Konjugasi Menurut Bronsted Lo My XXX Hot Girl
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.