
asam basa konjugasi soal kimia SMA YouTube
Pembahasan : Menurut Lewis: • Asam: zat/senyawa yang dapat menerima pasangan elektron bebas dari zat/senyawa lain. • Basa: zat/senyawa yang dapat mendonorkan pasangan elektron bebas dari zat/senyawa lain. Jika reaksi diatas digambarkan dengan rumus Lewis, maka senyawa SO3 akan bertindak sebagai asam lewis: 2.

31++ Contoh Soal Tentang Asam Basa Konjugasi Contoh Soal Terbaru
Pelajari Juga: 40 Contoh Soal Kimia Kelas XI beserta Jawabannya PDF (Semester II) HNO 3 + CH 3 COOH ↔ CH 3 COOH 2+ + NO 3-. Pasangan yang merupakan asam basa konjugasi adalah . . . . A. CH3COOH dan CH3COOH2+. B. HNO3 dan CH3COOH2+. C. CH 3 COOH dan HNO 3. D. NO 3- dan CH 3 COOH 2+. E. CH 3 COOH dan NO 3-. Jawaban: A.

Soal Larutan Asam Basa
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Konsep Asam Basa dalam bentuk pdf pada link dibawah ini: Modul Konsep Asam Basa; Kumpulan Soal Mudah, Sedang & Sukar; Asam dan Basa. Dari beberapa ratus tahun yang lalu, ahli-ahli kimia telah menemukan dan mendefinisikan beragam senyawa yang disebut asam dan basa.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

pembahasan soal SBMPTN SAINTEK 2018 KIMIA KODE 470 no43,asam basa konjugasi YouTube
Pasangan asam- basa konjugasi adalah teori yang di cetuskan oleh Bronsted-Lowry. Dimana asam adalah zat yang memberikan/donor proton(H +) sehingga di akhir akan berkurang 1 H +.. Ok demikian rangkuman materi dan contoh soal asam basa & titrasi berikut video pembelajaran dan latihan soalnya. Kumpulan pertanyaan tentang asam dan basa berikut.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Asam basa konjugasi adalah zat dengan sifat asam dan zat dengan sifat basa dapat berpasangan. Berikut cara menentukan pasangan asam basa konjugasi. Contoh Soal UAS Geografi: Letak Astronomis, Geografis, dan Geologis Indonesia. Skola. 06/03/2024, 10:00 WIB. Ciri-ciri Kelompok Sosial, Apa Sajakah itu? Skola. 06/03/2024, 09:00 WIB.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Soal nomor 43 SBMPTN 2018 ini menguji pemahaman tentang konsep asam-basa konjugasi (konsep asam-basa Bronsted-Lowry) serta konsep asam basa Lewis. Menentukan zat mana yang berperan sebagai asam/basa konjugasi dari yang lain.. Pembahasan Soal Nomor 34 Kode: 412 Pasangan asam basa konjugasi cirinya adalah kemiripan rumus kimia dengan selisih.

Mana yang berfungsi sebagai asam, basa, asam konjugasi, d...
Asam dan Basa Konjugasi - RumusKimia.net berikut akan berbagi penjelasan tentang Asam dan Basa Konjugasi. Untuk pengertian Asam dan Basa Konjugasi.. Contoh Soal Asam dan Basa Konjugasi. Berikut ini contoh pasangan asam-basa konjugasi pada beberapa reaksi. a. HNO 3(aq) + H 2 O (l) ⇄H 3 O + (aq) + NO 3.

Asam basa konjugasi kimia SMA YouTube
Asam konjugasi dari HSO4^(-) adalah. Perkembangan Konsep Asam dan Basa. Share. 01:44. Jika pH larutan 0,01 M suatu asam lemah HA adalah 3,5, ma. pH Asam Kuat, Basa Kuat, Asam Lemah, dan Basa Lemah; Asam dan Basa; Kimia Fisik dan Analisis; Kimia; Share. 2; 3; 4. Ngerti materi dengan Tanya. Cari soal Matematika, Fisika, Kimia dan tonton.

Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
1 - 15 Contoh Soal Asam Basa dan Jawaban. 1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . . a. Meningkatkan [H +] bila dimasukkan kedalam H 2 O. b. Menurunkan [H +] bila dimaasukkan kedalam H 2 O. d. Menerima 1 H + dari pasangan reaksinya.
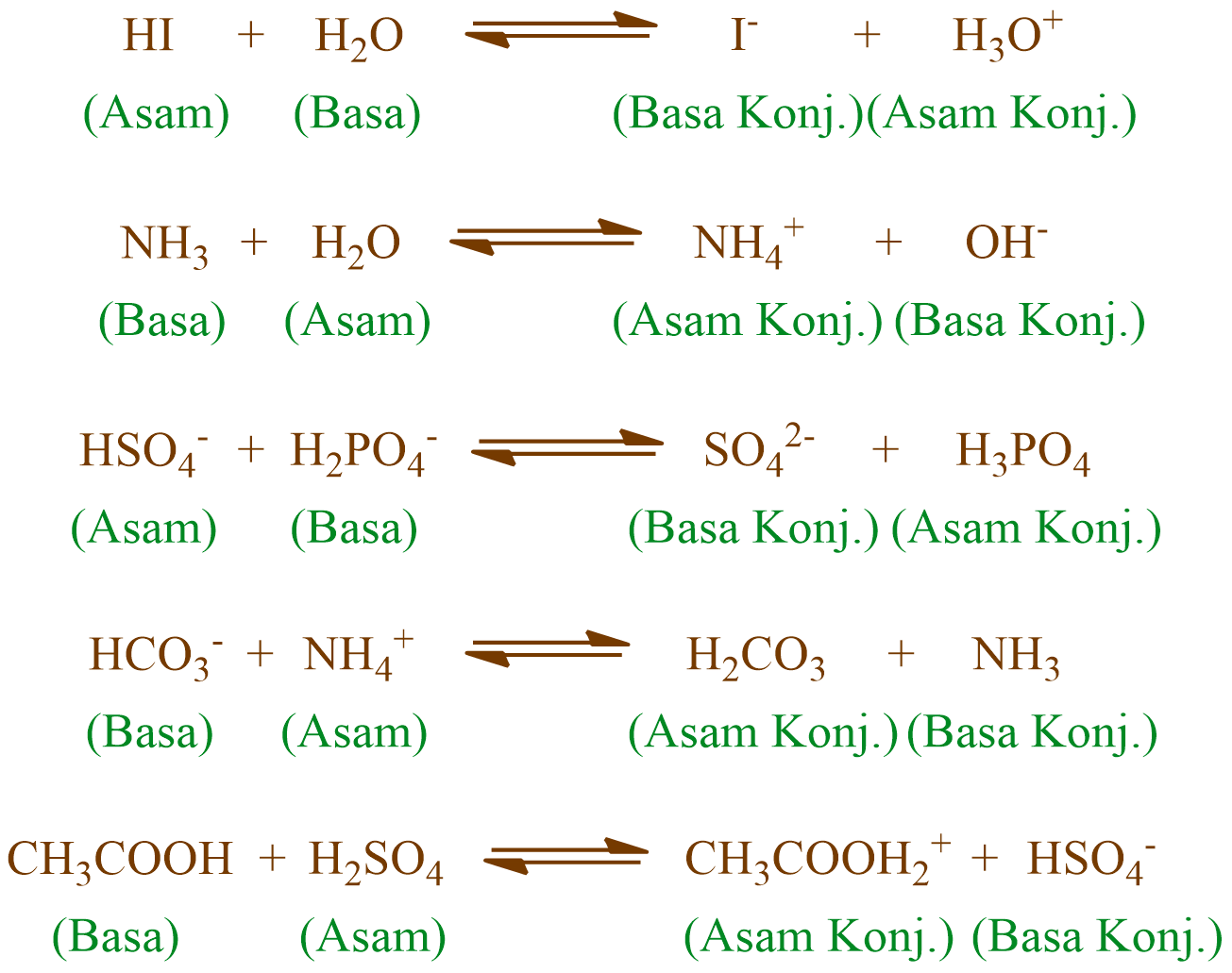
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Reaksi Asam Basa - Rumus Kimia - Contoh Soal dan Jawaban. Ilustrasi dans sumber foto: Pixabay Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium.Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air.

Asam dan Basa Konjugasi
Asam lemah: HA + H 2 O ⇌ H 3 O + + A - (basa kuat) Basa sesaat setelah menerima proton akan berubah menjadi asam konjugasi dari basa tersebut. Contoh tipe reaksi: Basa kuat: B + H + → BH + (asam lemah) Bila ditulis secara lengkap: Basa kuat: B + H 3 O + → BH + (asam lemah) + H 2 O. Basa lemah: B + H + ⇌ BH + (asam kuat) Bila ditulis.

Asam basa konjugasi soal kimia SMA YouTube
Video berisi tentang cara menentukan pasangan asam basa konjugasi dari teori asam basa Bronsted-Lowry. Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semu.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
1 - 15 Contoh Soal Larutan Penyangga dan Pembahasan. 1. Pernyataan yang benar tentang larutan penyangga adalah.. a. mempertahankan pH sistem agar tetap. b. memiliki komponen asam dan basa yang selalu berupa pasangan konjugasi. c. mampu mengatasi penambahan asam dan basa dalam jumlah banyak.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Soal Pembahasan Teori Asam Basa Nomor 6 rukim.id. Diketahui persamaan reaksi asam-basa Bronsted-Lowry berikut: H 2 PO 4- + H 2 O ⇌ H 3 PO 4 + OH-. H 2 PO 4- + H 2 O ⇌ PO 43- + H 3 O +. Berdasarkan teori asam-basa Bronsted-Lowry, sifat spesi H 2 O dalam kedua reaksi tersebut adalah.. A. Reaksi 1: bersifat asam karena.
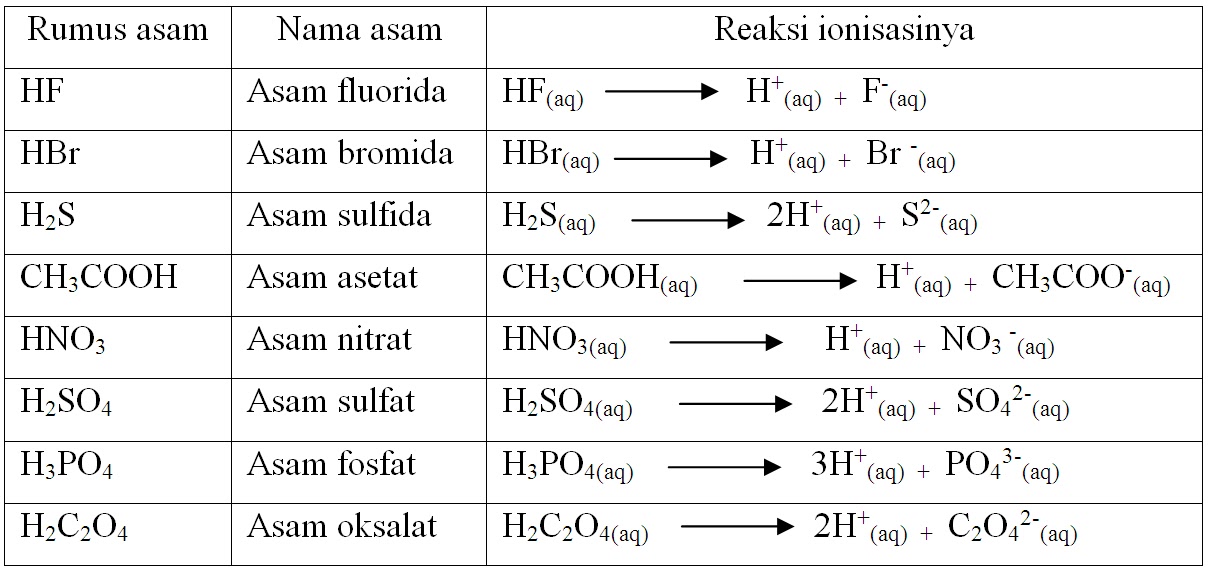
28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Reaksi NH4 ke NH3. Asam Basa Konjugat - Konjugasi Asam Basa - Rumus, Konjugat, Contoh Soal dan Jawaban. Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium.Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air.