Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Membandingkan kenaikan titik didih larutan nonelektrolit dan larutanelektrolit pada konsentrasi yang sama. III. Landasan Teori : Suhu dimana cairan mendidih dinamakan titik didih. Jadi, titik didih adalah temperatur dimana tekanan uap sama dengan tekanan atmosfer.. Kimia Dasar II Organik (FPU6171) 54 Documents. Students shared 54 documents.
Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
Latihan Soal Kenaikan Titik Didih & Penurunan Titik Beku (Sukar) Pertanyaan ke 1 dari 5. Sebanyak 2,85 gram AX2(Mr = 95) dilarutkan ke dalam air sehingga diperoleh 200 mL larutan. Ternyata titik didih larutan tersebut 100, 1404 ∘ C. Ke dalam larutan tersebut ditambahkan 0,95 gram AX2 dan kemudian larutan diencerkan lima kali.

Sifat Koligatif Larutan Berdasarkan Kenaikan Titik Didih Larutan My XXX Hot Girl
Jumlah partikel terlarut sebenarnya sebanding dengan berat jenis dari larutan maka akan terjadi hubungan, jika berat jenis bertambah maka titik beku dan kenaikan titik didih dari pelarut murninya akan menurun (Sitanggang, 2019). Titik didih adalah suhu pada saat tekanan uap cari sama dengan tekanan di permukaan.

Rumus Dan Contoh Soal Kenaikan Titik Didih Larutan Elektrolit Dan Non Riset
Sehingga akan dapat menambah pemahaman mengenai kenaikan titik didih zat. iv f BAB II KAJIAN TEORI A. Kenaikan Titik didih Suhu dimana cairan mendidih dinamakan titik didih. Jadi, titik didih adalah temperatur dimana tekanan uap sama dengan tekanan atmosfer. Selama gelembung terbentuk dalam cairan, berarti selama cairan mendidih, tekanan uap.
Kenaikan Titik Didih Dan Penurunan Titik Beku Riset
Kenaikan titik didih larutan air 50 mL + gula 1,5 gr pada percobaan didapat 91 oC, sedangkan pada perhitungan didapat 92,045 o C. Dari data yang ada pada tabel dan analisis dapat dilihat bahwa nilai dari titik didih dari larutan garam dan larutan gula memiliki nilai yang berbeda yakni 94 ˚C dan 93 ˚C.

Sifat Koligatif Larutan Part 2 Kenaikan Titik Didih dan Penurunan Titik Beku Kimia Kelas XII
Titik didih alkana dalam deret homolognya mengalami kenaikan sebesar kurang lebib 30 0C untuk setiap penambahan CH 2. Akan tetapi, adanya percabangan dalam struktur molekul hidrokarbon cenderung menurunkan titik didih. Umumnya, kenaikan titik didih disebabkan meningkatnya gaya tarik Van Der Waals antara molekul.

Melihat Proses Kenaikan Titik Didih Kimia Kelas 12 Belajar Gratis di Rumah Kapan Pun! Blog
Jumlah partikel terlarut sebenarnya sebanding dengan berat jenis dari larutan maka akan terjadi hubungan, jika berat jenis bertambah maka titik beku dan kenaikan titik didih dari pelarut murninya akan menurun (Sitanggang, 2019). Titik didih adalah suhu pada saat tekanan uap cari sama dengan tekanan di permukaan.

KIMIA KELAS XII SIFAT KOLIGATIF LARUTAN "KENAIKAN TITIK DIDIH LARUTAN" YouTube
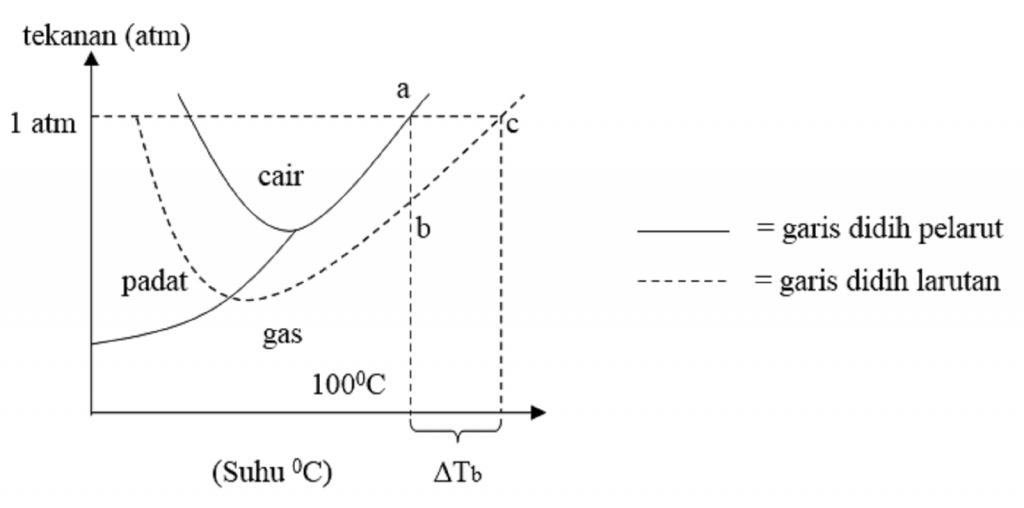
Kenaikan titik didih. Kenaikan titik didih menggambarkan fenomena bahwa titik didih dari cairan (suatu pelarut) akan lebih tinggi ketika senyawa lain ditambahkan, yang berarti bahwa larutan akan memiliki titik didih yang lebih tinggi daripada pelarut murninya. Hal ini terjadi ketika zat terlarut yang tidak mudah menguap, seperti garam.

Sifat Koligatif Larutan Part 1 Penurunan Tekanan Uap dan Kenaikan Titik Didih YouTube
Dasar Teori Penurunan Titik Beku Larutan merupakan suatu campuran yang homogen dan dapat berwujud padatan maupun cairan. Akan tetapi larutan yang paling umum dijumpai adalah larutan cair, dimana suatu zat tertentu dilarutkan dalam pelarut berwujud cairan yang sesuai hingga konsentrasi tertentu (Sastrohamidjojo, 2001). Sifat koligatif larutan merupakan sifat larutan yang tidak bergantung pada.
Cara Menentukan atau Menghitung Kenaikan Titik Didih Larutan SERBA SERBI
Tujuan : 1. Menyelidiki titik didih larutan serta faktor yang mempengaruhi. 2. Membandingkan kenaikan titik didih larutan nonelektrolit dan larutanelektrolit pada konsentrasi yang sama. III. Landasan Teori : Suhu dimana cairan mendidih dinamakan titik didih. Jadi, titik didih adalah temperatur dimana tekanan uap sama dengan tekanan atmosfer.

kenaikan titik didih(penjelasan di deskripsi) YouTube
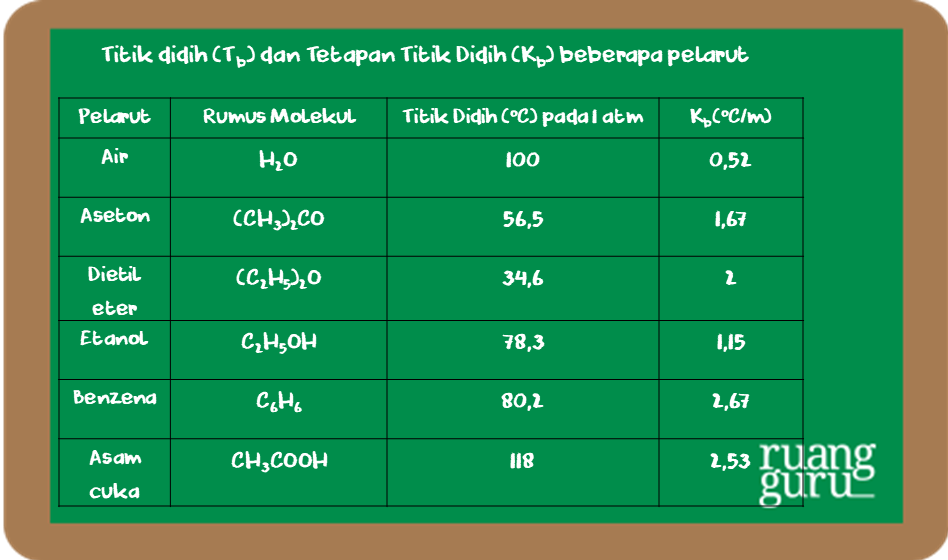
T b° = titik didih pelarut murni (air) T b = titik didih larutan. Kenaikan titik didih hanya tergantung pada jenis pelarut dan molaritas larutan, tidak tergantung pada jenis zat terlarut. Jika ditambahkan zat terlarut yang tidak mudah menguap, misalnya gula, maka dibutuhkan kenaikan titik didih yang cukup besar agar dapat mendidih.

KENAIKAN TITIK DIDIH ELEKTROLITNONELEKTROLIT YouTube
Selisih antara titik didih larutan dengan titik didih pelarut inilah yang disebut dengan kenaikan titik didih ( ∆T b ). Rumus untuk menentukan kenaikan titik didih ( ∆T b ) adalah: Untuk larutan yang bersifat elektrolit, maka persamaannya akan berubah menjadi: T b = K b . m [ 1 + ( n - 1 ) α ]

Tetapan kenaikan titik didih molal (Kb) tergantung pada.
LAPORAN PRAKTIKUM Kenaikan titik didih. devi nadiya widjaya. Download Free PDF View PDF. Laporan titik leleh dan titik didih. Devii Purba.. Menentukan titik didih beberapa zat II. DASAR TEORI A. TITIK LELEH Titik leleh adalah temperatur dimana zat padat berubah wujud menjadi zat cair pada tekanan satu atmosfer. Dengan kata lain, titik leleh.

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
Kenaikan titik didih adalah salah satu dari empat sifat koligatif larutan, yaitu sifat larutan yang dipengaruhi oleh partikel zat pelarut. Kenaikan titik didih larutan adalah peristiwa di mana titik didih suatu larutan akan lebih tinggi daripada pelarut murninya. Misalnya, air memiliki titik didih 100 derajat celcius.

Kenaikan Titik Didih PDF
Persiapan UTBK 2023 Lengkap di aplikasi Pahamify: https://linktr.ee/mipipahamifyBersama Kak Yuli, kita akan belajar tentang 2 sifat koligatif larutan, kenaik.

Bab iv kenaikan titik didih
Laporan Kenaikan Titik Didih Larutan 6, April 2013 BAB I PENDAHULUAN I. Judul Kenaikan titik didih larutan II. Latar Belakang Titik didih adalah suhu dimana cairan mendidih, dimana tekanan uap sebuah zat cair sama dengan tekanan eksternal yang dialami cairan. Larutan dapat dibagi menjadi dua berdasarkan nilai titik didih zat terlarut. Pertama.