
Bentuk Molekul Tipe dan Teori VSEPR, Domain Elektron Quipper 2023
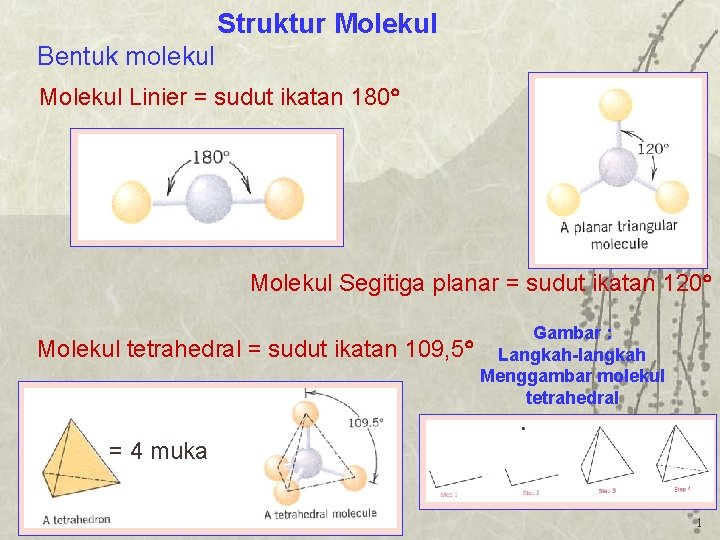
Molekul ini mempunyai sudut ikatan yang berbeda. Sudut ikatan yang ada di pusat bidang datar segitiga, setiap sudutnya sebesar 120 derajat. Sementara, sudut ikatan antara bidang pusat dan titik sudut atas-bawah adalah 90 derajat. Contoh molekul berbentuk trigonal bipiramidal adalah PCl5. 7. Oktahedral
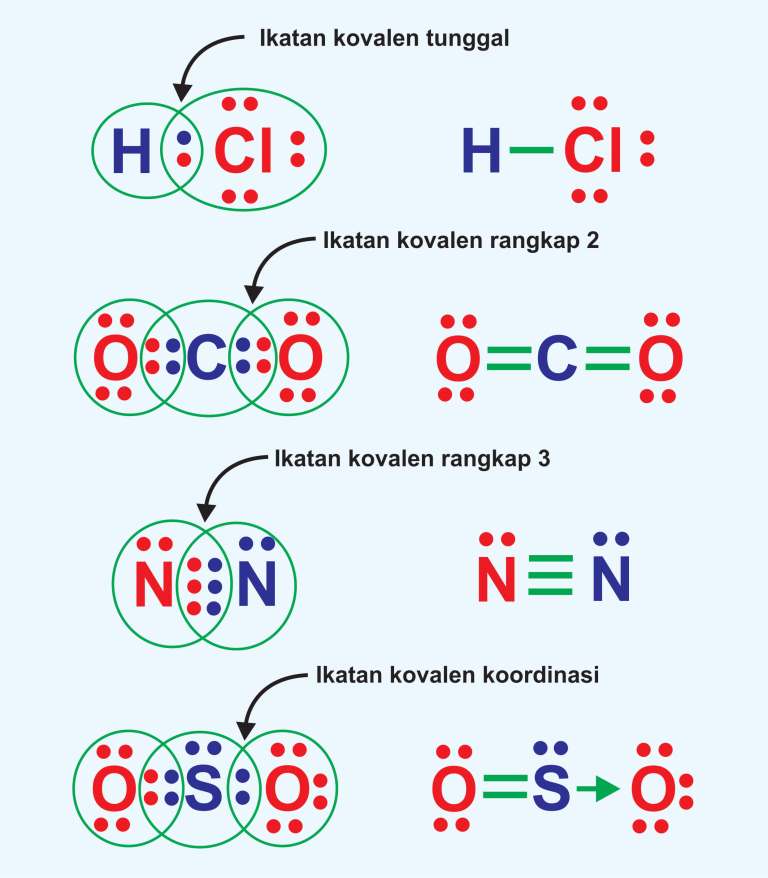
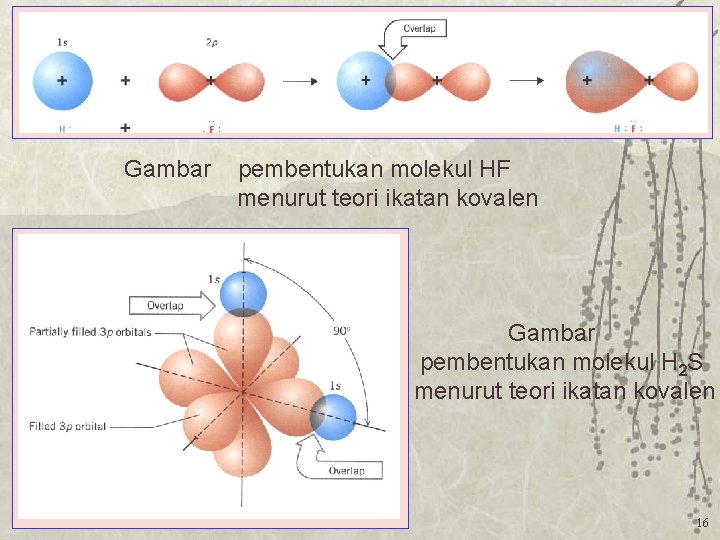
Dasar teori tentang ikatan kovalen
1. Pengertian Ikatan Kimia. Ikatan kimia adalah gaya tarik menarik yang kuat antara atom-atom tertentu bergabung membentuk molekul atau gabungan ion-ion sehingga keadaannya menjadi lebih stabil. Dua atom atau lebih dapat membentuk suatu molekul melalui ikatan kimia. Ikatan kimia terjadi karena penggabungan atom-atom, yang membentuk molekul.
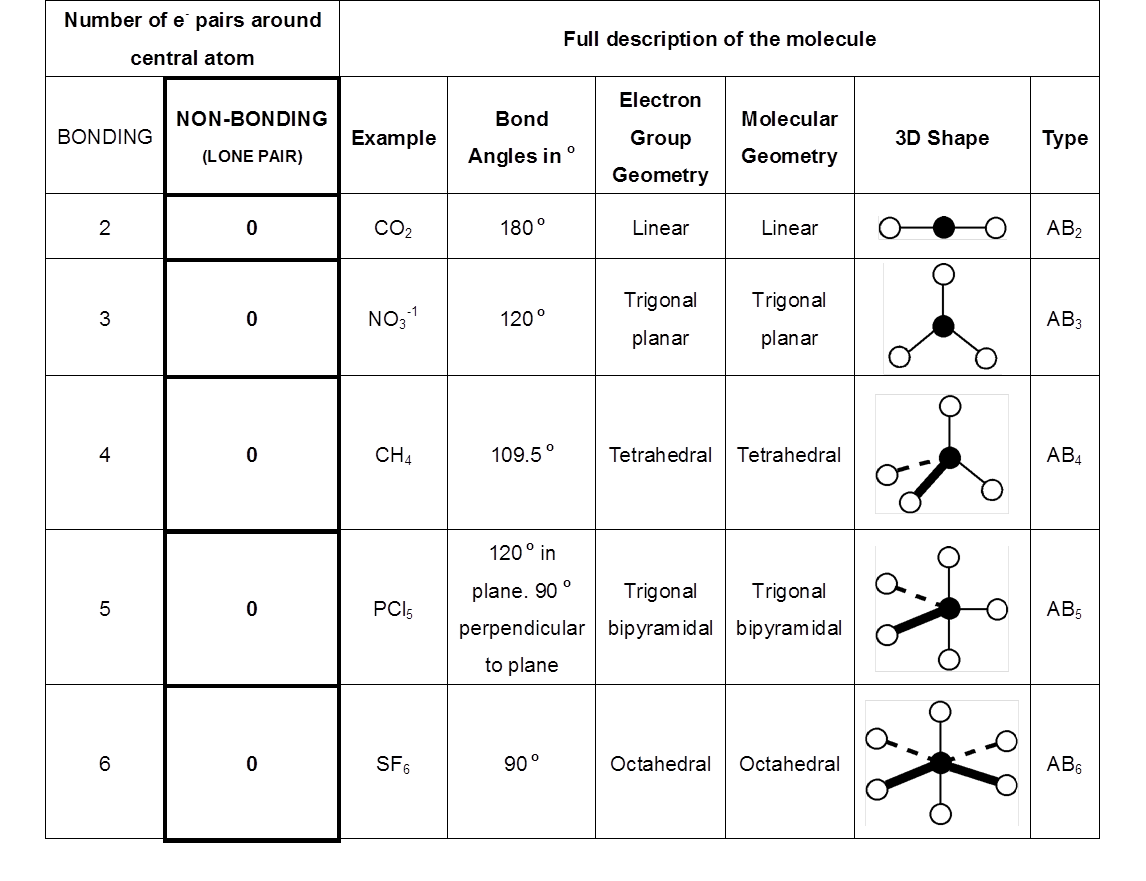
STRUKTUR MOLEKUL BERDASARKAN TEORI VSEPR ILMU KAULA
Hibridisasi Kimia Kelas 10 - Pengertian, Tipe, Cara Menentukan, dan Contoh Soal. Hibridisasi adalah proses bergabungnya orbital atom pusat dengan orbital atom lainnya sehingga terbentuk orbital hibrida. Sedangkan bentuk molekul merupakan susunan atom-atom di dalam molekul dalam bentuk tiga dimensi. Artikel ini akan membahas bentuk molekul dan.

Bentuk Molekul, Sudut Ikatan PDF
Hubungan antara jenis hibridisasi atom pusat dengan bentuk molekul. Bila dirangkum, maka berikut ini hubungan antara jenis hibridisasi atom pusat dengan bentuk molekul. Contoh Soal Teori VSEPR dan Pembahasannya. Tentukan tipe molekul untuk senyawa berikut! a. $\mbox{SF}_{4}$ b. $\mbox{BF}_{3}$ Jawaban. Kedua molekul ini memiliki ikatan tunggal.

Struktur Molekul Bentuk molekul Molekul Linier sudut ikatan
Macam-Macam Molekul. Adapun macam-macam molekul ada dua yakni molekul unsur dan molekul senyawa. Berikut penjelasannya: 1. Molekul Unsur. Molekul unsur merupakan molekul yang terbentuk dari hasil penggabungan atom atau unsur yang satu jenis. Molekul unsur ini pada intinya adalah molekul yang terdiri dari satu jenis atom atau unsur saja.

Struktur Molekul Bentuk molekul Molekul Linier sudut ikatan
Molekul Unsur : Definisi: Molekul-molekul ini terdiri dari atom-atom dari satu unsur yang terikat secara kimia menjadi satu. contoh: Oksigen (O2), Nitrogen (N2), dan Klorin (Cl2) adalah contoh umum di mana dua atom dari unsur yang sama terikat bersama. atomisitas: Istilah ini menunjukkan jumlah atom yang ada dalam molekul suatu unsur.

Struktur Molekul Bentuk molekul Molekul Linier sudut ikatan
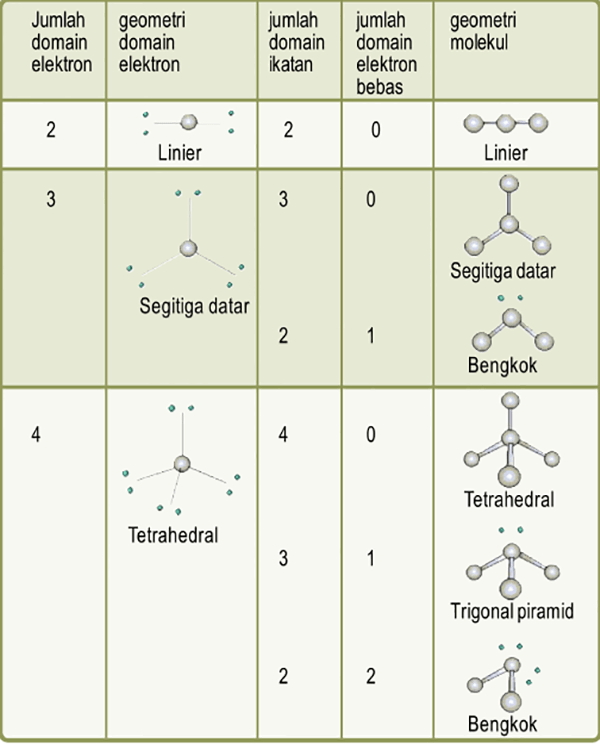
Geometri molekul adalah penataan atom yang menyusun molekul secara tiga dimensi. Geometri molekul menentukan beberapa sifat zat termasuk reaktivitas, polaritas, wujud zat, warna, magnetisme dan aktivitas biologisnya. [1] [2] [3] Sudut antara ikatan yang membentuk atom hanya bergantung lemah pada molekul tersebut, yaitu, mereka dapat dipahami.
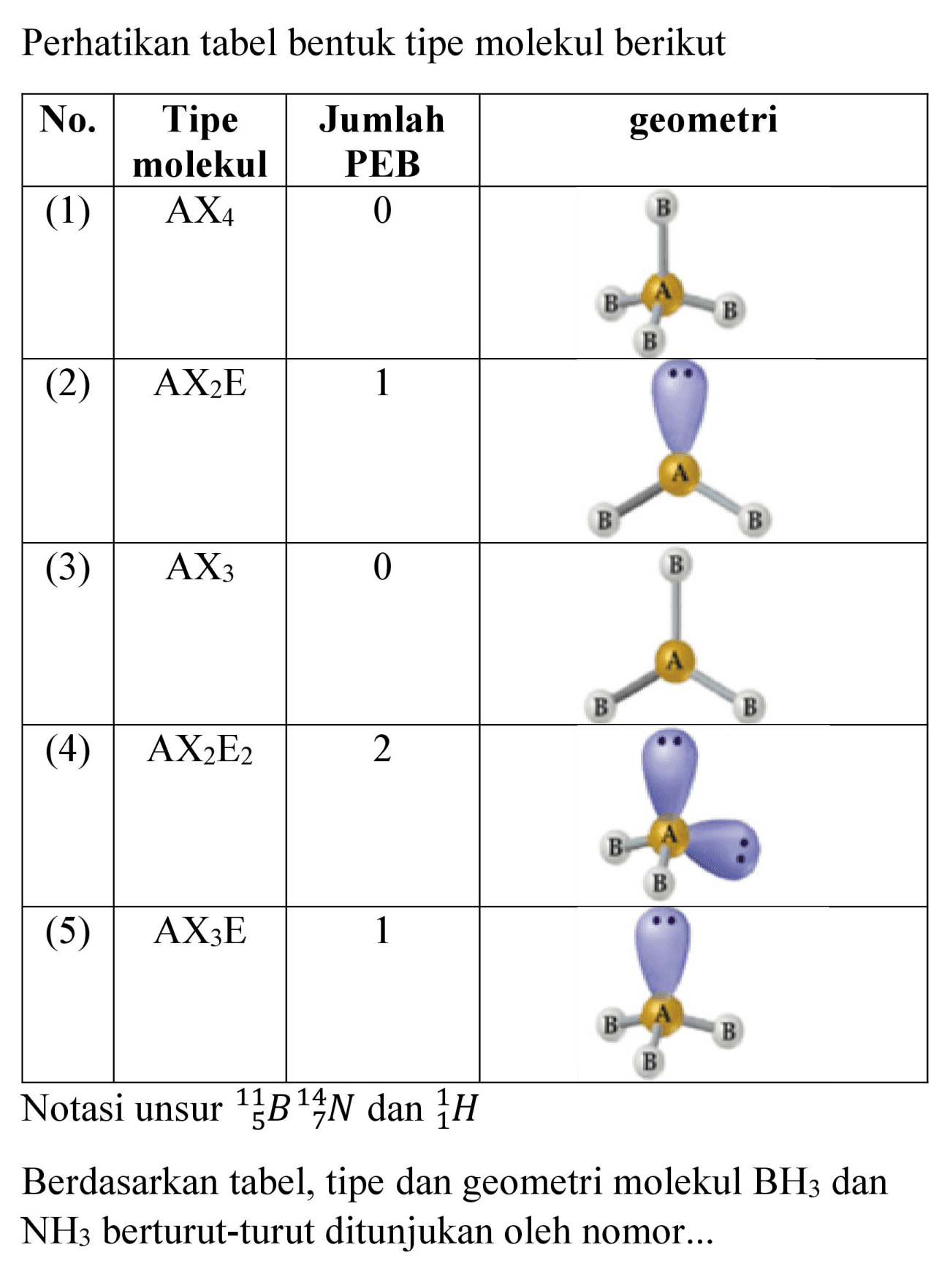
Ramalkan bentuk molekulmolekul di bawah ini dengan mengg...
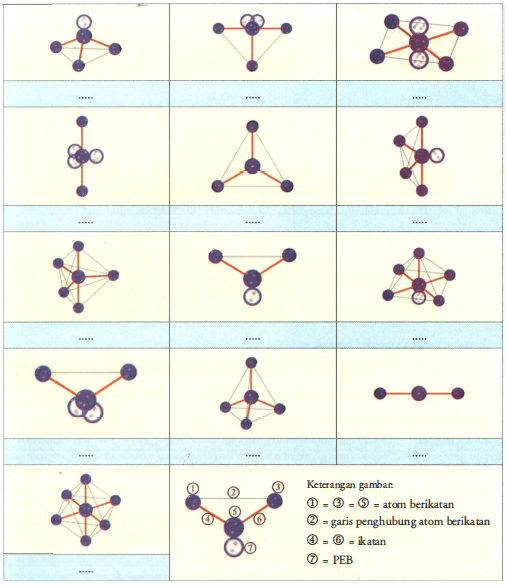
Tipe Molekul = AX2. . , berbentuk linear dengan sudut 180∘. Sudut ikatan suatu molekul dipengaruhi keberadaan PEB. Gaya tolak PEB yang lebih besar dari PEI, menyebabkan PEB memerlukan ruang lebih besar dan memaksa ruang PEI untuk menyempit atau sudut ikatannya semakin kecil. Semakin banyak PEB dalam suatu molekul maka sudut ikatannya semakin.

Bentuk Geometri dan Interaksi Molekul Kimia Kelas X MIPA
n: jumlah PEI dalam molekul. E: pasangan elektron bebas (PEB) m: jumlah PEB dalam molekul. Ada 11 bentuk molekul berdasarkan teori domain elektron, yaitu linear, segitiga planar, segiempat piramida, seesaw atau jungkat-jungkit, bentuk T, oktahedral, bentuk bengkok, tetrahedral, segitiga piramida, bentuk V, dan segitiga bipiramida.
Pertemuan 2 Hibridisasi dan Ikatan Rangkap Terkonjugasi
Geometri Molekul. Selamat Datang dan Selamat Belajar di Wardaya College! Di sini, kamu akan belajar tentang Geometri Molekul melalui latihan soal interaktif dalam 3 tingkat kesulitan (mudah, sedang, sukar). Apabila materi ini berguna, bagikan ke teman atau rekan kamu supaya mereka juga mendapatkan manfaatnya.
Struktur Molekul Bentuk molekul Molekul Linier sudut ikatan
Di antara molekul-molekul di bawah ini, yang mempunyai ikatan kovalen rangkap dua adalah.. N 2 (nomor atom N = 7) H 2. Pasangan senyawa berikut yang molekulnya polar dan non-polar berturut-turut adalah.. CH 4 dan CCl 4.. Sudut ikatan pada molekul H 2 O adalah 104,5°, padahal pasangan-pasangan elektron menempati posisi ruang.
Berilah nama bentukbentuk molekul berikut dengan
Gaya antarmolekul adalah interaksi antara atom-atom dalam senyawa atau kumpulan molekul dalam senyawa yang mengalami tarik-menarik. Kuat lemahnya gaya tarik-menarik antarmolekul akan berpengaruh terhadap tinggi rendahnya titik didih suatu senyawa. Urutan kekuatan gaya antarmolekul berdasarkan kekuatan dari yang terlemah hingga yang terkuat adalah sebagai berikut.

Struktur Molekul Bentuk molekul Molekul Linier sudut ikatan
Diantara molekul berikut yang sudut ikatannya paling besar adalah.. - 8805742 rini336 rini336. Sekolah Menengah Pertama terjawab Diantara molekul berikut yang sudut ikatannya paling besar adalah.. a.h2o b.BeCl2 c.NH3 d. pcl3 e.Bf3 1 Lihat jawaban Iklan. Suatu ion m2 mempunyai 18 elektron dan 20 neutron. pernyataan yang benar tentang.
Catatanku Geometri Molekul Dan Menentukan Bentuknya Menurut Teori Vsepr My XXX Hot Girl
Ikatan logam adalah ikatan yang tebentuk akibat penggunaan bersama elektron-elektron valensi antar atom-atom logam. (Kimia 1, J.M.C. Johari dan M. Rachmawati, Esis,2006, Hal: 130) 18. Di antara molekul-molekul dibawah ini, yang mempunyai ikatan kovalen rangkap dua adalah . . . a. N 2 (nomor atom N = 7) b. O 2 (nomor atom O = 8) c. H 2 (nomor.

Struktur Molekul Bentuk molekul Molekul Linier sudut ikatan
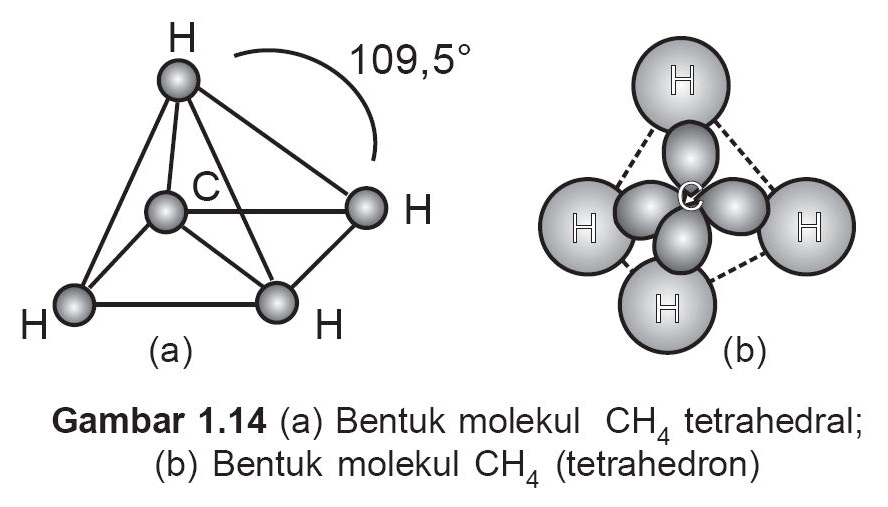
Contoh: Sudut ikatan: BeF 2 (180°) > BF 3 (120°) > CH 4 (109,5°) BeF 2 hibridisasinya sp, BF 3 hibridisasinya sp 2, dan CH 4 hibridisasinya sp 3. 2. Jumlah PEB. Jika hibridisasi atom pusat sama, tetapi jumlah PEB-nya berbeda maka maka yang memiliki PEB lebih banyak akan memiliki sudut ikatan lebih kecil.
jenis sudut ikatan Anthony Hudson
Di antara molekul-molekul di bawah ini, yang mempunyai ikatan kovalen rangkap dua adalah.. Jawaban: Oksigen (O) memiliki konfigurasi elektron "2, 6" dengan 6 elektron valensi dan kekurangan 2 elektron, maka akan ada 2 elektron yang digunakan bersama dan membentuk ikatan kovalen rangkap ganda, dengan Struktur Lewis: