
Contoh Senyawa Kovalen Polar Dan Nonpolar Terbaru
Ciri senyawa polar adalah adanya pasangan elektron bebas pada atom pusat. Pada senyawa CI 4, atom karbon (C) menjadi atom pusat dan memiliki empat elektron untuk berikatan dengan empat atom I. Sehingga elektron atom C terpakai semua untuk berikatan dan atom C sudah tidak memiliki elektron yang tersisa. Oleh karena itu, senyawa CI 4 bersifat.

Cara Mencari Rumus Molekul Unsur dan Senyawa Kimia Kelas 10 Belajar Gratis di Rumah Kapan
Dua kelas utama molekul adalah molekul polar dan molekul nonpolar. Beberapa molekul jelas polar atau nonpolar, sementara yang lain berada di suatu tempat pada spektrum antara dua kelas. Berikut adalah melihat apa arti polar dan nonpolar, bagaimana memprediksi apakah suatu molekul akan menjadi satu atau yang lain, dan contoh senyawa perwakilan.
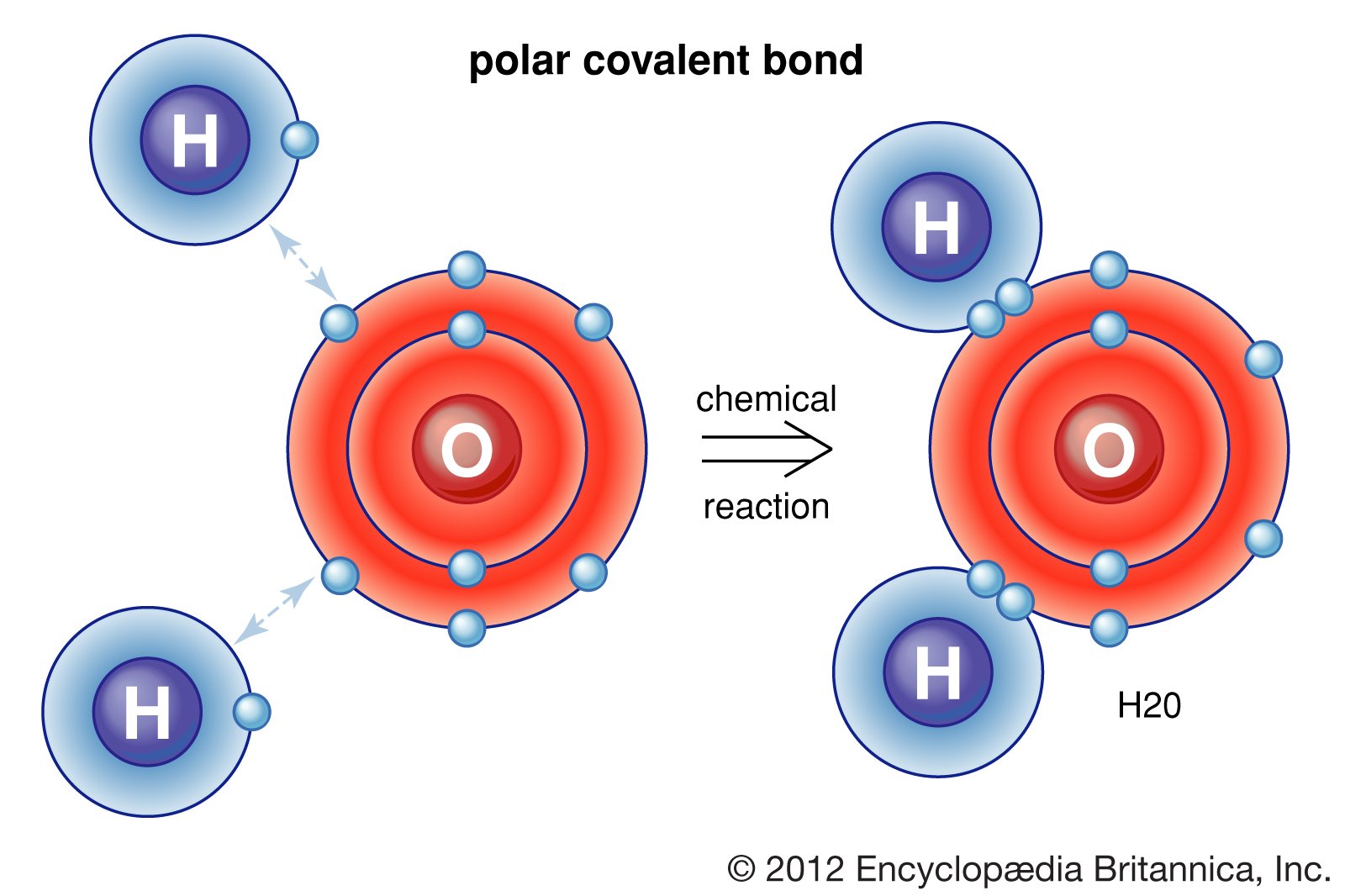
10 Contoh Soal dan Pembahasan Ikatan Kovalen Polar dan Nonpolar Materi Kimia
Contoh reaksi yang akan dibahas adalah sebabagi berikut: Pengantar Belajar Kimia Organik 49 Methanol di sisi lain merupakan nukleo l yang buruk apa
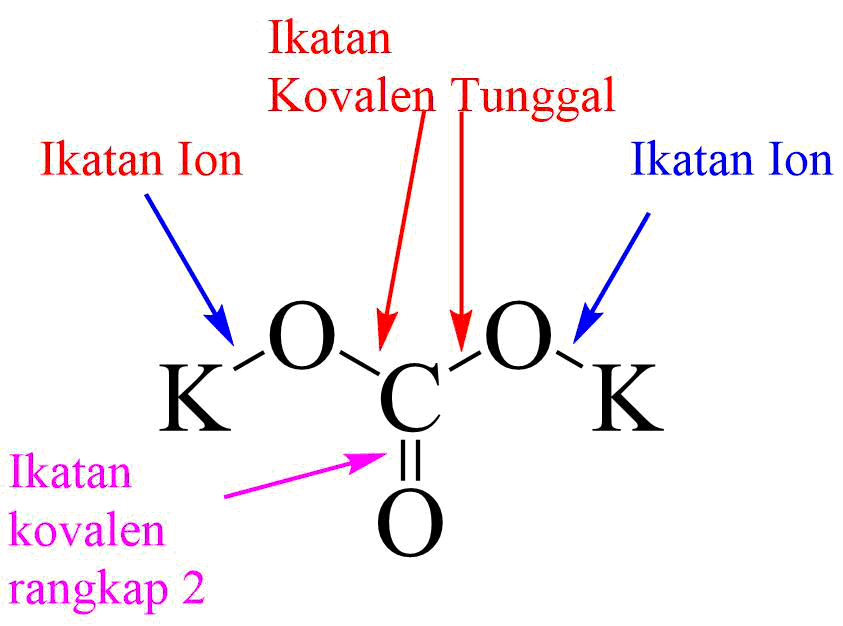
pengertian senyawa ion dan senyawa kovalen polar Matt Jackson
Senyawa kovalen non polar juga biasanya memiliki bentuk gas atau cair pada suhu kamar. Baca juga: Ikatan Kovalen Koordinasi: Pengertian dan Contohnya. Ikatan kovalen non polar terjadi karena kesamaan keelektronegativan atom-atom yang saling terikat. Di mana jika perbedaan keelektronegativan dua atom di bawah 0,4.

Contoh Senyawa Kovalen Polar Format Soal
Pelarutan Senyawa Ionik dan Kovalen. Ngomong-ngomong tentang larutan, terbentuknya itu kan karena adanya interaksi antara zat terlarut dan zat pelarut. Nah, yang namanya interaksi, berarti kita akan nyerempet-nyerempet ke jenis ikatan kimia, seperti ikatan ionik, kovalen, polar, dan nonpolar. Contohnya larutan garam (NaCl) dilarutkan oleh air.

Senyawa Senyawa Yang Antar Atomnya Berikatan Kovalen Disebut jenis peralatan teknologi komunikasi
Gaya antarmolekul adalah interaksi antara atom-atom dalam senyawa atau kumpulan molekul dalam senyawa yang mengalami tarik-menarik. Kuat lemahnya gaya tarik-menarik antarmolekul akan berpengaruh terhadap tinggi rendahnya titik didih suatu senyawa. Urutan kekuatan gaya antarmolekul berdasarkan kekuatan dari yang terlemah hingga yang terkuat adalah sebagai berikut.

perbedaan senyawa ion dan kovalen polar Carolyn Simpson
Senyawa kovalen memiliki tingkat kelarutan yang rendah dibandingkan dengan senyawa lainnya. Terlebih untuk senyawa kovalen yang termasuk kovalen non polar seperti CO2, CH4, dan CCl4. Sedangkan kovalen polar memiliki kemampuan yang lebih baik namun tidak lebih baik dibandingkan senyawa ion. Contoh kovalen polar yaitu NH3, HCl, dan NO2.

perbedaan senyawa ion kovalen polar kovalen non polar Sebastian Grant
Contoh ikatan kovalen jenis ini adalah pembentukan senyawa HCl dan CH4. a. Pembentukan HCl. Konfigurasi elektron 1H : 1s1 sehingga elektron valensinya = 1. Untuk mencapai konfigurasi elektron yang stabil (sesuai kaidah duplet) diperlukan 1 elektron. Konfiguarsi elektron 17Cl adalah 1s2 2s2 2p6 3s2 3p5 sehingga CI dan mempunyai elektron valensi = 7.
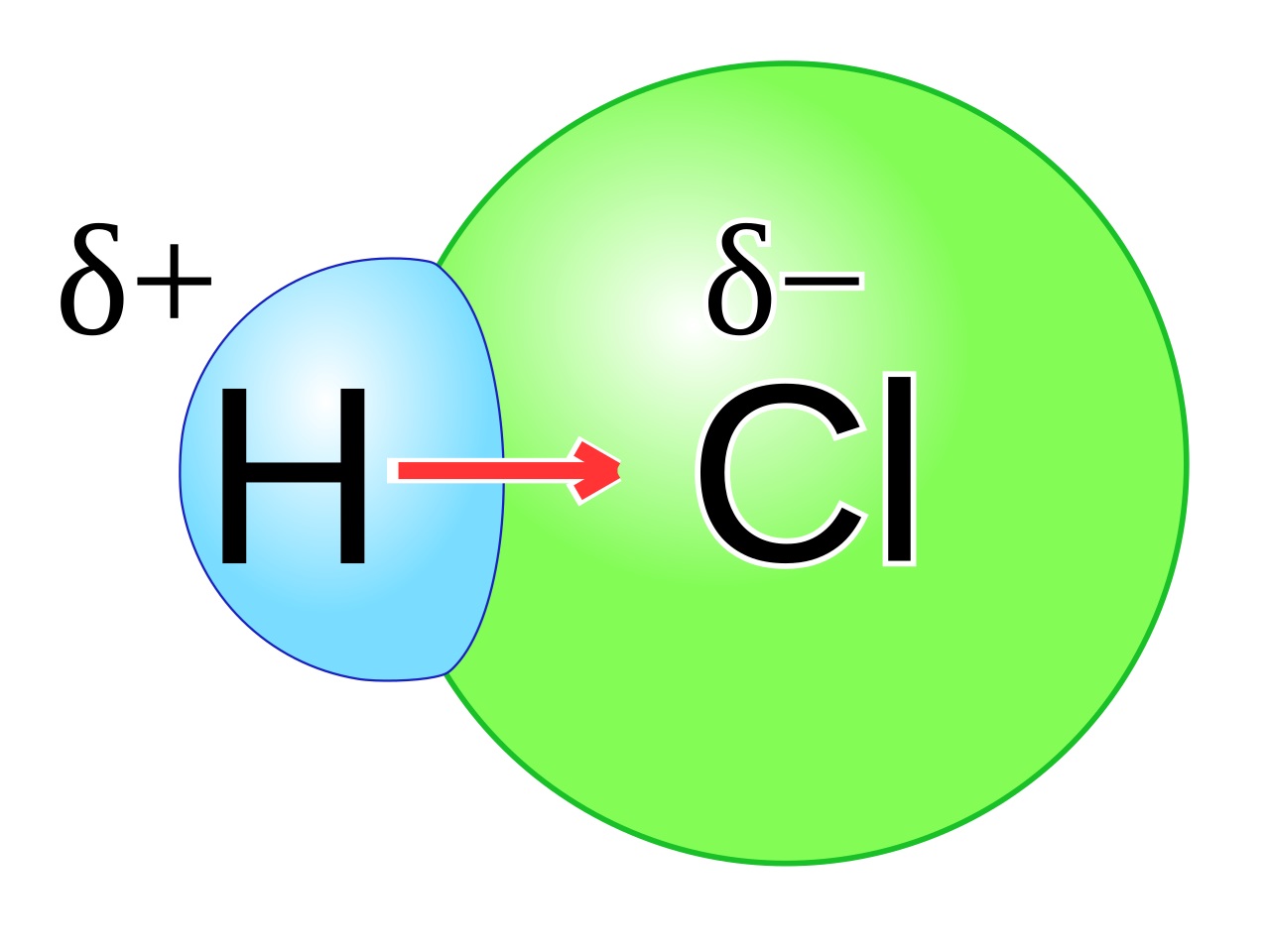
Contoh Senyawa Kovalen Polar
Pasangan unsur yang membentuk ikatan kovalen adalah.. A. 17 X dan 11 Y. B. 12 P dan 17 Q. C. 6 R dan 17 Q. D. 20 M dan 16 T. E. 19 A dan 35 B. Soal nomor 5. Deretan senyawa berikut ini tergolong senyawa kovalen, kecuali. A. HF, HCl, HI. B. BH 3, BF 3, CO 2. C. H 2 O, NH 3, CO 2. D. Li 2 O, CaO, MgO. E. IF 5, CCl 4, CF 4. Soal nomor 6. Di.

MENENTUKAN BENTUK MOLEKUL PADA IKATAN KOVALEN
Adapun sifat-sifat dari ikatan kovalen adalah sebagai berikut. Sebagian senyawa yang memiliki ikatan kovalen mudah menguap. Memiliki titik didih dan titik leleh yang rendah. Tidak larut dalam air, tapi larut dalam larutan organik. Pada umumnya, tidak menghantarkan listrik. Berupa cairan, gas, atau padatan lunak pada suhu ruang.

Contoh Senyawa Ion Dan Senyawa Kovalen Polar Merupakan senyawa ion atau kovalen polar. lursdert
Gaya yang terjadi antara molekul polar dengan molekul polar disebut. Gaya London.. Di antara senyawa berikut yang bukan molekul kovalen polar adalah..(No. atom H=1, N=7, O=8, Na=11, P=15, Cl = 17, Br=35) NO. PH 3.. Di bawah ini adalah senyawa non-polar, kecuali. . H 2. Cl 2. CH 4. HCl. CCl 4. 18. Multiple Choice. Edit. 1 minute.

Pasangan Senyawa Berikut Yang Bersifat Polar Dan Nonpolar tanggung jawab kelompok kerja
Senyawa kovalen nonpolar yaitu terjadi antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri. Contoh : , . Dengan demikian,senyawa yang bukan molekul kovalen polar adalah . Hal ini, karena adalah senyawa ion yang tersusun dari unsur logam (Na) dan nonlogam (Cl).

perbedaan senyawa ion dan senyawa kovalen Karen Welch
Senyawa Kovalen Polar dan Non-Polar. Di antara senyawa berikut, yang tidak memenuhi kaidah oktet adalah .. A. BF3 B. SF2 C. NH3 D. NaCl E. H2O. Senyawa Kovalen Polar dan Non-Polar. Ikatan Kimia, Bentuk Molekul, dan Interaksi Antarmolekul. Kimia Anorganik. Kimia.
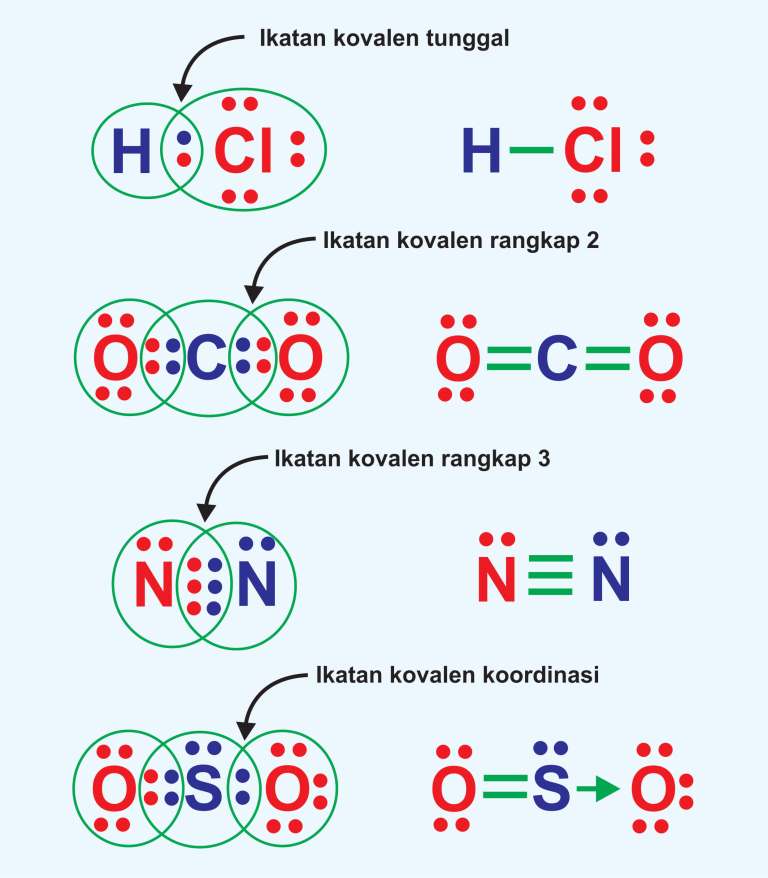
Dasar teori tentang ikatan kovalen
Latihan Soal Gaya Dipol Permanen (Sedang) Pertanyaan ke 1 dari 5. 1. Pertanyaan. Berikut ini hubungan yang tepat antara interaksi antar dipol dan gaya London sehubungan dengan sifat fisis senyawa adalah.. 1. Titik didih hanya dipengaruhi oleh gaya London. 2. Titik didih hanya dipengaruhi oleh interaksi antar dipol.

Ikatan kovalen Polar dan Non Polar Alsen Saloka Blog's
Molekul senyawa berikut yang bukan merupakan senyawa kovalen polar adalah.. A. HCl. B. H 2 O. C. NH 3. D. CHCl. E. Cl 2. Jawaban: E Pembahasan: Molekul Cl 2 terdiri dari 2 atom yang sama yaitu Cl sehingga selisih keelektronegatifannya adalah 0. Hal tersebut tidak mengakibatkan terjadinya pemisahan kutub oleh karena itu Cl 2 adalah senyawa nonpolar.. Soal No. 2

Ciriciri dari senyawa ion dan senyawa kovalen
Di dalam senyawa kovalen, berbagai macam unsur yang berbeda terdapat di dalam molekul oleh ikatan kovalen. Ikatan kovalen merupakan ikatan kimia bersama atom yang berpasangan dan berbagi dengan elektron valensi. Gaya tarik yang terjadi adalah antara elektron bersama. Inti positif dari kedua atom memegang atom bersama-sama dalam suatu molekul.