
Diantara reaksireaksi dibawah ini yang merupakan reaksi redoks adalah . . . a. AgNO3 (aq
Halo Koperasi di sini ada soal tentang penyetaraan reaksi redoks setengah reaksi oksidasi dari reaksi tersebut adalah yang mana Oke jadi di sini ada aturan bilangan oksidasi atau biloks yang pertama biloks unsur bebas akan sama dengan nol yang kedua jumlah dilaksanakan dalam yang sama dengan muatannya yang ketiga. Jumlah bilangan unsur-unsur.
Diketahui reaksi redoks berikut P(s) + NO[3] (aq)...
Indikator Titrasi Reduksi Oksidasi (Redoks) Titik akhir dari titrasi redoks dapat ditetapkan secara visual melalui reaksi redoks itu sendiri. Perubahan warna pada saat titik akhir tercapai dapat diketahui dengan penambahan indikator. Indikator merupakan senyawa organik yang dapat mengalami perubahan warna apabila terjadi perubahan biloks.

Penyetaraan Reaksi Redoks Cara Setengah Reaksi YouTube
Penerapan Reaksi Redoks dalam Kehidupan Sehari-Hari. Di awal artikel, gue sempet mention beberapa contoh, lalu bagaimana nih penerapan reaksi redoks dalam kehidupan sehari sehari. Nah, supaya elo gampang mengingat, gue udah buat daftar contohnya berikut ini: Pembakaran. Tahu nggak sih, oksigen yang ada di atmosfer bumi itu mengalami penurunan.

Diketahui reaksireaksi redoks dalam industri berikut. (1...
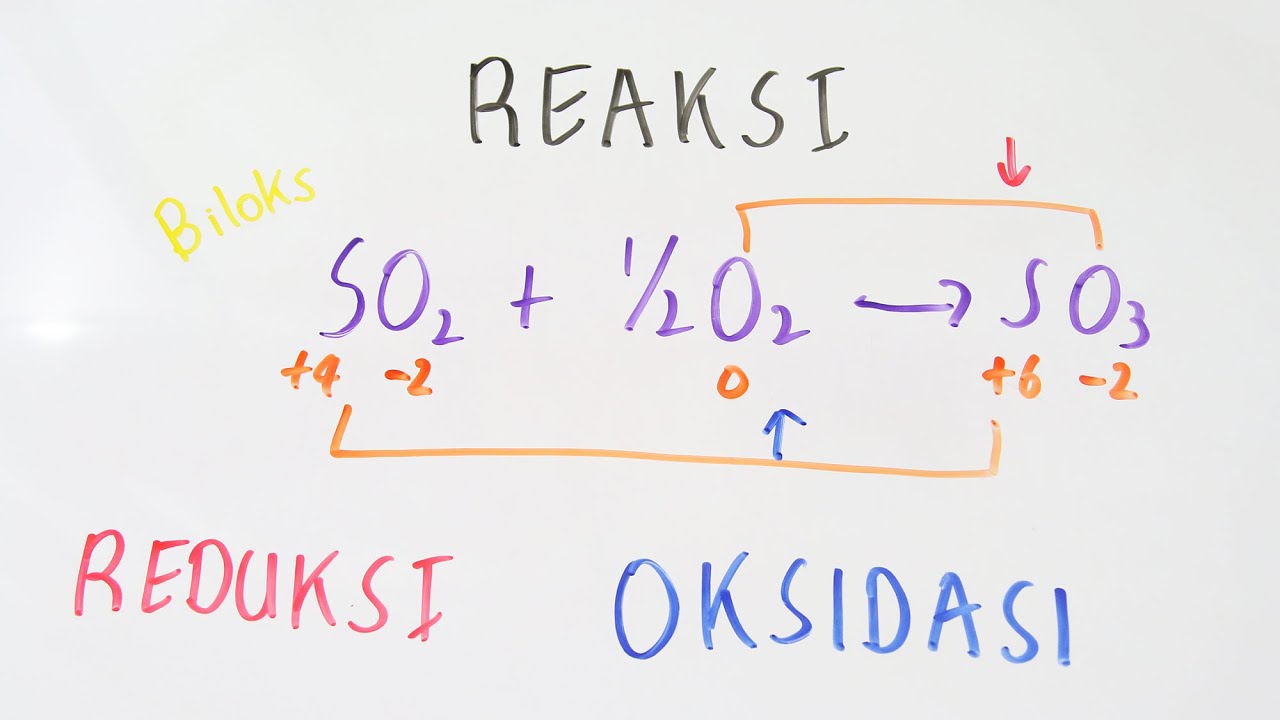
Contoh reaksi redoks dalam kehidupan sehari-hari adalah zat pemutih untuk menghilangkan warna, fotosintesis, dan pembakaran.. Guna mengetahui suatu reaksi tergolong reaksi redoks atau bukan, menurut konsep perubahan bilangan oksidasi, perlu diketahui bilangan oksidasi dari setiap atom, baik dalam pereaksi maupun hasil reaksi..
Contoh Soal Reaksi Redoks Dan Pembahasannya
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

Diketahui persamaan reaksi redoks berikut aCr2O7^(2)
Reaksi redoks dapat dibedakan berdasarkan perubahan bilangan oksidasi, sehigga untuk menentukan spesi yang mengalami reduksi dan oksidasi, perlu diketahui nilai biloksnya. Penentuan Bilangan Oksidasi Penentuan bilangan oksidasi dapat dilakukan dengan mengikuti aturan berikut [3, 4].

Diketahui reaksi redoks 3 FeCl2 (aq) + H2S (g) > 2 FeCl...
Pemahaman Akhir. Reaksi redoks merupakan reaksi yang terdiri dari reduksi (penerimaan elektron) dan oksidasi (penyisihan elektron). Konsep reaksi redoks dapat dilihat dari berbagai sudut pandang, seperti berdasarkan pengikatan dan pelepasan oksigen, pengikatan dan pelepasan elektron, atau penambahan dan penurunan bilangan oksidasi.

Diketahui persamaan reaksi redoks sebagai berikut.MnO4^
Reaksi redoks digunakan dalam berbagai metode analisis kimia, termasuk titrasi redoks, di mana konsentrasi suatu senyawa ditentukan berdasarkan reaksi redoks dengan senyawa standar yang telah diketahui konsentrasinya. 8. Industri Kimia.

Gas Klorin Dapat Dibuat Melalui Reaksi Redoks Berikut
Redoks Redoks atau redox adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia. Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh.
Contoh Reaksi Redoks Dalam Kehidupan Sehari Hari Beserta Reaksinya Berbagai Contoh
Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.

Konsep Reaksi Redoks
45+ Soal Penyetaraan Reaksi Redoks (Reduksi dan Oksidasi) [Update] Pada tahun 1774 seorang ilmuan bernama Joseph Priestley yang tercatat dalam sejarah melakukan penelitian terhadap oksigen di laboratorium dimana reaksi bersejarah ini juga merupakan reaksi oksidasi-reduksi. Priestley memanaskan merkuri oksida dan membentuk unsur merkuri dan oksigen.

Diketahui reaksi redoks berikut. Br2 (l) + KOH (aq...
Reaksi redoks adalah reaksi kimia di mana reduksi dan oksidasi terjadi. Langkah pertama dalam menyelesaikan setiap reaksi redoks adalah menyetarakan persamaan redoks.. Soal Reaksi Redoks. Diketahui persamaan redoks setara berikut untuk reaksi antara MnO 4 -dan Fe 2+ dalam larutan asam: MnO 4 -(aq).

Diketahui reaksi redoks berikut. aCr2O7^(2)(aq)+14H^+(aq...
Reaksi autoredoks/disproporsionisasi merupakan reaksi redoks dimana satu zat mengalami reaksi reduksi dan oksidasi sekaligus. Contoh: S merupakan hasil reduksi sekaligus hasil oksidasi;. Diketahui persamaan reaksi redoks. KMnO 4 (aq) + KI(aq) + H 2 SO 4 (aq) → MnSO 4 (aq) + I 2 (aq) + K 2 SO 4 (aq) +H 2 O(l)

Diketahui reaksi redoks setara berikut; 3As + 5NO3^ + 4O...
Langkah 1: Setarakan jumlah atom yang terlibat dalam reaksi, kecuali atom O dan H. MnO + PbO 2 → MnO 4- + Pb 2+. Langkah 2: Menentukan bilangan oksidasi masing-masing atom dalam reaksi dan menentukan spesi yang mengalami oksidasi serta reduksi. MnO + PbO 2 → MnO 4- + Pb 2+. sumber: dokumentasi pribadi.
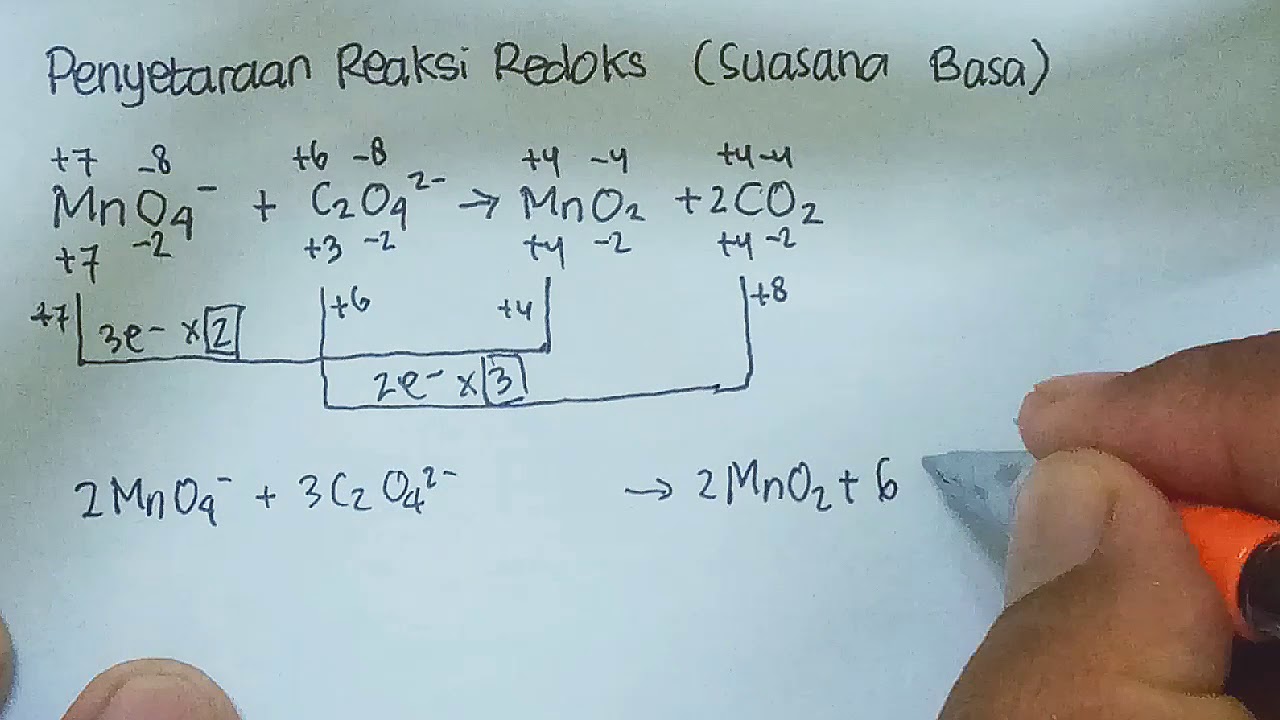
Diketahui reaksi redoks berikut ini MnO4^ + C2O...
Diketahui reaksi redoks (belum setara) sebagai berikut: BrO3^- + Br^- + H^+ -> Br2 + H2O Untuk menghasilkan 0,3 mol Br2 diperlukan ion Br^- (Ar = 80) sebanyak. Penyetaraan Persamaan Reaksi Redoks. Reaksi Redoks dan Sel Elektrokimia. Kimia Fisik dan Analisis.

Diketahui suatu reaksi redoks sebagai berikut. aBr^ + b...
Menentukan perubahan bilangan oksidasi dan menyamakan perubahan bilangan oksidasinya. 2. Memberikan koefisien reaksi pada reaksi oksidasi dan reduksinya sesuai angka pengalinya. 3. Menyamakan jumlah muatan pada kedua ruas persamaan reaksi. 4. Menyamakan jumlah dengan menambahkan . Maka koefisiennya: Jadi, jawaban yang benar adalah D.