10.Electrolysis of dilute H2SO4 liberates gases at anode and cathode respectively provide me
electrolysis, process by which electric current is passed through a substance to effect a chemical change. The chemical change is one in which the substance loses or gains an electron (oxidation or reduction). The process is carried out in an electrolytic cell, an apparatus consisting of positive and negative electrodes held apart and dipped.

H2so4 Enthalpy Of Formation
Dalam 1 mol H2SO4 terdapat 98 gram H2SO4. Jadi, jumlah mol H2SO4 dalam 500 gram larutan adalah: Jumlah mol = (500 g) / (98 g/mol) = 5.102 mol H2SO4. Menggunakan persamaan reaksi elektrolisis 2H2SO4 → 2H2 + O2, kita dapat mengetahui bahwa setiap 2 mol H2SO4 akan menghasilkan 2 mol H2 gas.
Contoh Soal Dan Pembahasan Elektrolisis Soal Kelasmu
Hasil elektrolisis larutan H2SO4 dengan elektrode Pt dapat digunakan dalam berbagai aplikasi industri, seperti produksi bahan kimia, pemurnian logam, dan sistem penyimpanan energi. Selain itu, hasil elektrolisis ini juga dapat digunakan dalam penelitian dan percobaan di laboratorium untuk mempelajari reaksi redoks. 5.

Contoh Soal Elektrolisis Homecare24
tuliskan reaksi elektrolisis larutan H2SO4 dengan. AU. ALDHA U. 26 Oktober 2021 02:20. Pertanyaan. tuliskan reaksi elektrolisis larutan H2SO4 dengan elektroda C 57. 1. Jawaban terverifikasi. Iklan. Iklan. ML. M. Larasati. 27 Oktober 2021 21:21. Jawaban terverifikasi. Hai Adha, Kakak coba bantu jawab. Elektrolisis ialah mengubah energi.
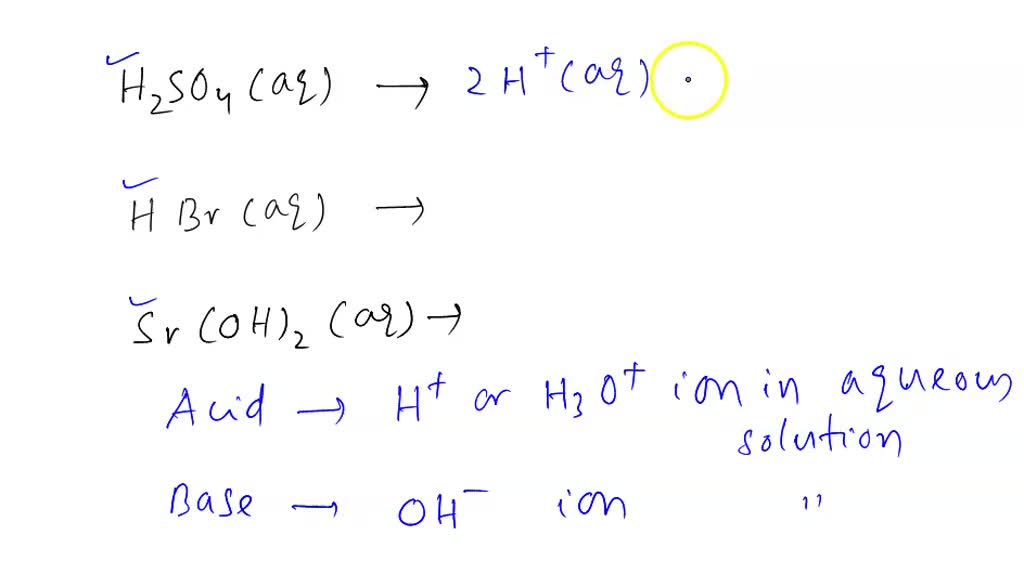
SOLVED Show the two step dissociation process for H2SO4. Do both acidic hydrogens dissociate 100?
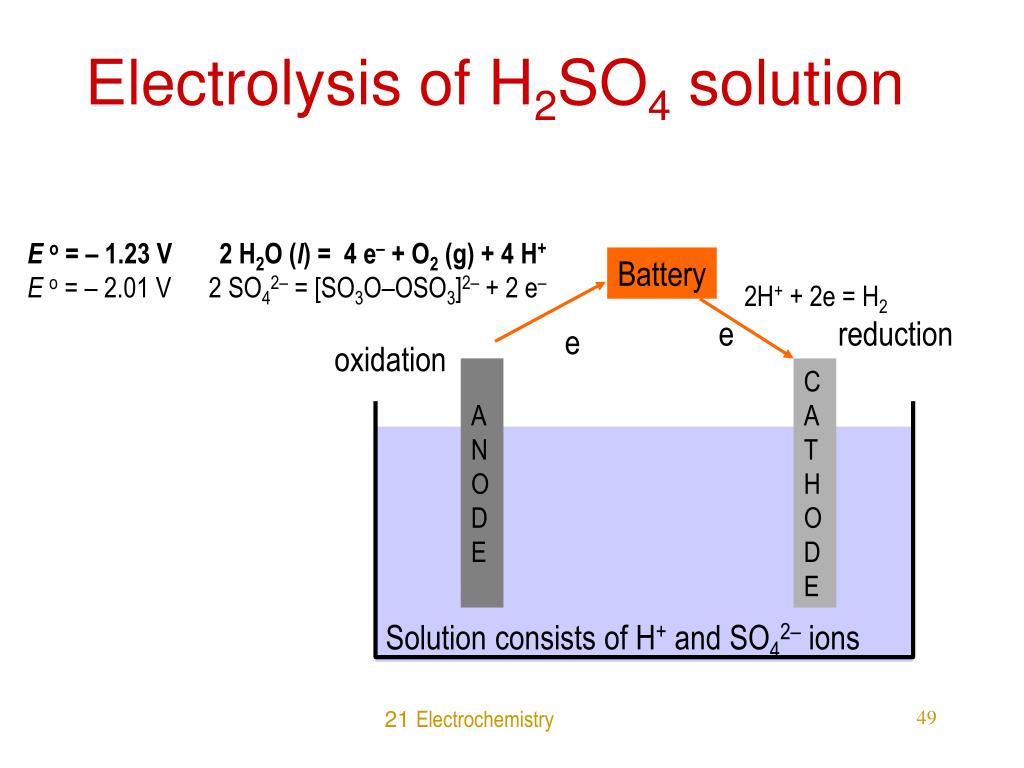
The half-equations for the electrolysis of water (electrolyte of acidified with dilute sulphuric acid). (a) The negative cathode electrode reaction for the electrolysis of water. The negative cathode electrode reaction is a reduction (electron gain). The hydrogen ions (H+) are attracted to the negative cathode and are discharged as hydrogen gas.

Jelaskan Prinsip Penggunaan Sebuah Bahan Ditaruh Di Suatu Elektroda (Anoda Atau Katoda
MAKALAH LAPORAN PRAKTIKUM SEL ELEKTROLISIS GURU PEMBIMBING Arianto, M.Pd. MATA PELAJARAN Kimia DISUSUN OLEH Adil Pratama Andita Olivia Putri Ciko Christian Gita Wulandari Jenny Blessia Gerung SMA NEGERI 1 KUALA KAPUAS XII IPA 1 TA. 2022/2023 KATA PENGANTAR Dengan menyebut nama Allah yang Maha Pengasih lagi Maha Penyayang, Tuhan yang Maha Esa, puji syukur atas rahmat yang dilimpahkan-Nya, kami.

PPT LISTRIK ARUS SEARAH PowerPoint Presentation, free download ID4714695
Click here:point_up_2:to get an answer to your question :writing_hand:electrolysis of 50 h2so4 produces. Solve. Guides. Join / Login. Use app Login. 0. You visited us 0 times! Enjoying our articles? Unlock Full Access! Standard XII. Chemistry. Question. Electrolysis of 50 % H 2 S O 4 produces: H 2 S 2 O 8 at anode; H 2 at anode; H 2 S O 5 at.
PPT 21 Electrochemistry PowerPoint Presentation, free download ID826545
In some textbooks, it may be said that for the electrolysis of dilute H2SO4 H 2 S O 4, the oxidation half-equation is written as 2HX+ +2eX− HX2 2 H X + + 2 e X − H X 2 and the reduction half-equation is written as 4OHX− 2HX2O +OX2 +4eX− 4 O H X − 2 H X 2 O + O X 2 + 4 e X −. However, the concentrations of these ions in solution are.

Pada Elektrolisis Larutan Pbcl2 Menggunakan Elektroda Inert Lengkap
jadi, ini soal dan jawaban mengenai reaksi elektrolisis larutan H2SO4 menggunakan elektroda grafit. kebetulan di sekolahku ada soal seperti ini.maaf jika ban.

37+ Materi Dan Contoh Soal Elektrolisis Rochelle Proctor
Pada elektrolisis larutan garam logam alkali dan alkali tanah tidak terbentuk logamnya, tetapi terbentuk gas H 2 . Hal ini disebabkan E o reduksi ion logam alkali dan alkali tanah.. 17. 0.0. Jawaban terverifikasi. Iklan. Iklan. Larutan Na 2 SO 4 dielektrolisis dengan elektroda Pt. Zat yang dihasilkan di katoda adalah.
Pelajaran Kimia Tuliskan Reaksi Elektrolisis Dari Larutan Cacl My XXX Hot Girl
Reaksi elektrolisis larutan encer dengan elektrode grafit. Hasil elektrolisisnya adalah gas oksigen di anode dan gas hidrogen di katode. 2. Reaksi elektrolisis larutan dengan elektrode tembaga. Oleh karena anodenya dari Cu (anode reaktif), maka anode tersebut mengalami oksidasi dan hasilnya adalah ion di anode dan gas hidrogen di katode. Nah.

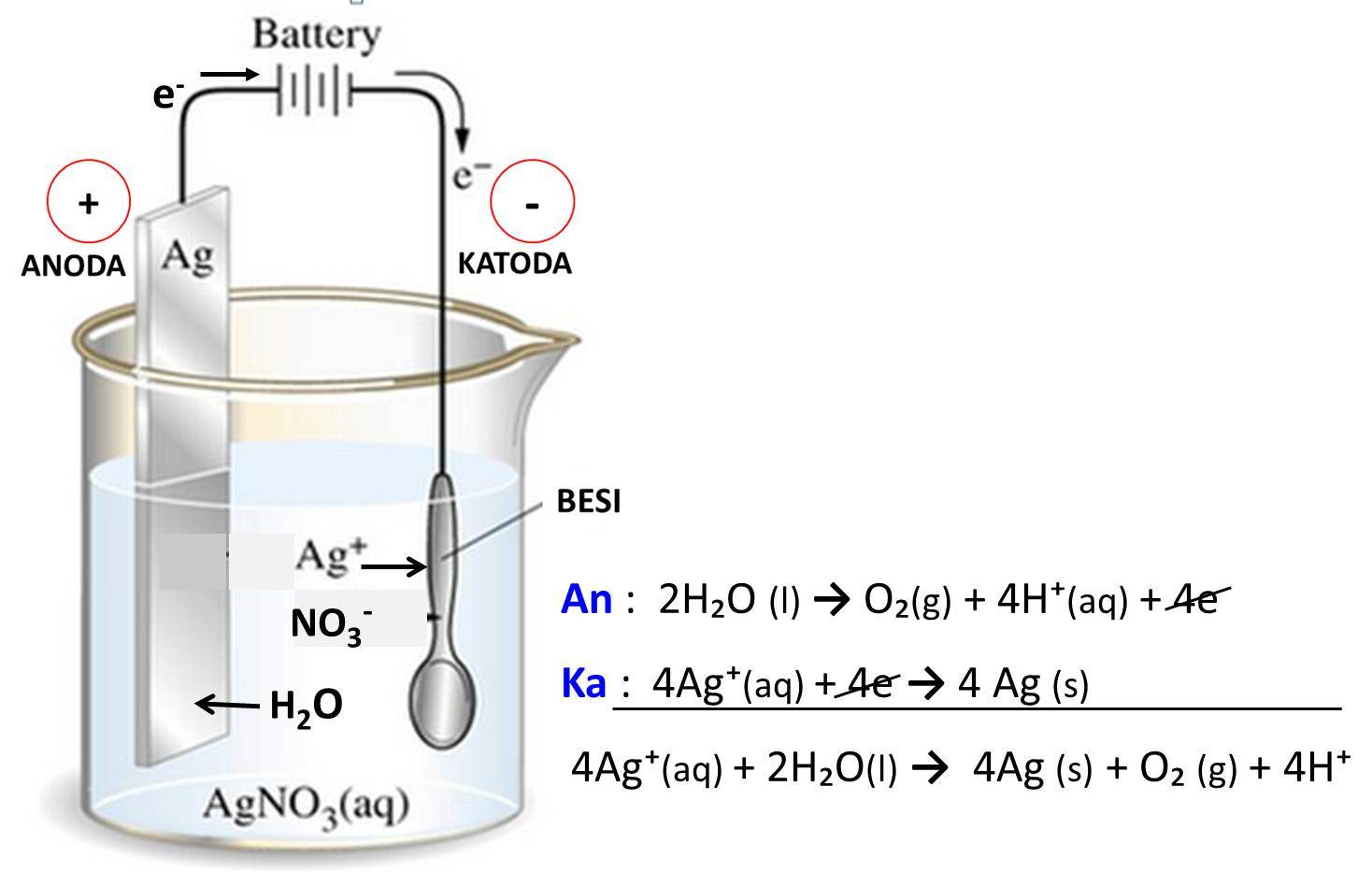
Pada elektrolisis larutan CuSO4 seperti terlihat pada gam...
Pertanyaan. Elektrolisis larutan H2SO4 encer dengan elektroda Pt, dihasilkan 22.4 liter gas hydrogen (diukur pada STP). Jika muatan listrik yang digunakan untuk elektrolisis larutan H2SO4 tersebut dalam jumlah sama digunakan untuk elektrolisis larutan CuSO4, massa tembaga yang diendapkan adalah..
Electrolysis of H2SO4 (conc.) gives the following atanode (1) H2 (2) O2 (3) H2S203 (4) H2S2O8
Elektrolisis larutan H2SO4 memiliki kelebihan seperti produksi gas yang berguna dan pemisahan senyawa H2SO4, namun juga memiliki kekurangan seperti biaya yang tinggi dan risiko pencemaran lingkungan. Sebelum melakukan elektrolisis larutan H2SO4, pastikan Anda memahami langkah-langkahnya dengan baik dan menjaga keselamatan selama proses.

MUATAN FORMAL3 MENENTUKAN KESTABILAN STRUKTUR LEWIS H2SO4 YouTube
This video shows the operation of an electrolytic cell & the experimental method of electrolysis. It carefully visualizes the mechanism of electrolysis in wh.
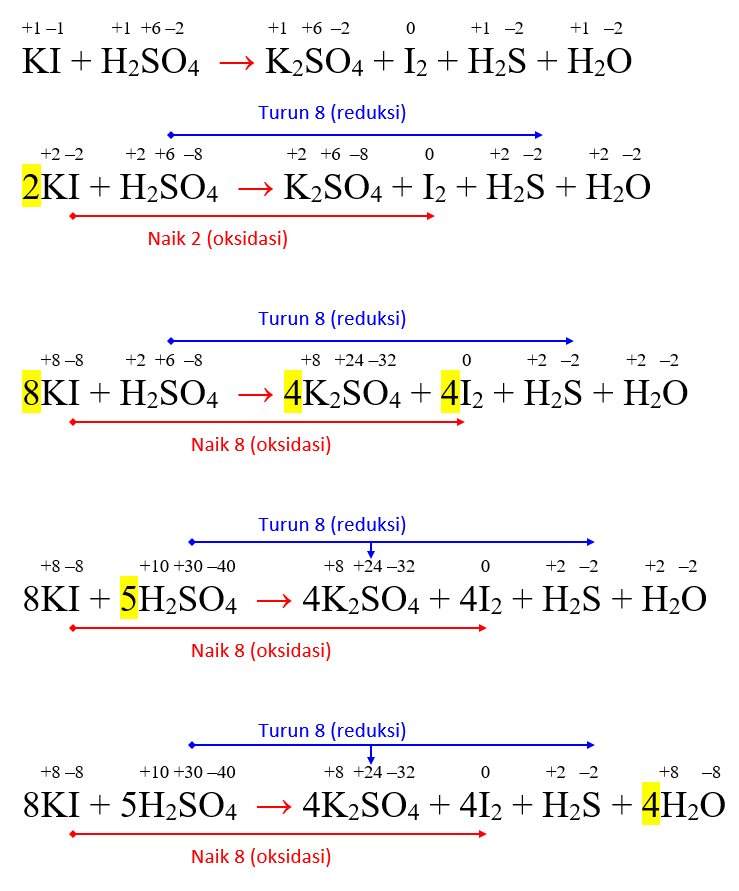
Penyetaraan Reaksi Redoks KI + H2SO4 → K2SO4 + I2 + H2S + H2O Serba Ada
Secara teoritis, sel elektrolisis merupakan bagian dari sel elektrokimia, di mana energi listrik digunakan untuk menjalankan reaksi redoks tidak spontan. Secara umum, sel elektrolisis tersusun dari: - Elektrolit, yaitu zat yang dapat menghantarkan listrik. - Sumber listrik yang menyuplai arus searah ( Direct Current = DC), misalnya baterai.

Penggunaan Sel Elektrolisis Dalam Industri dan Kehidupan Seharihari
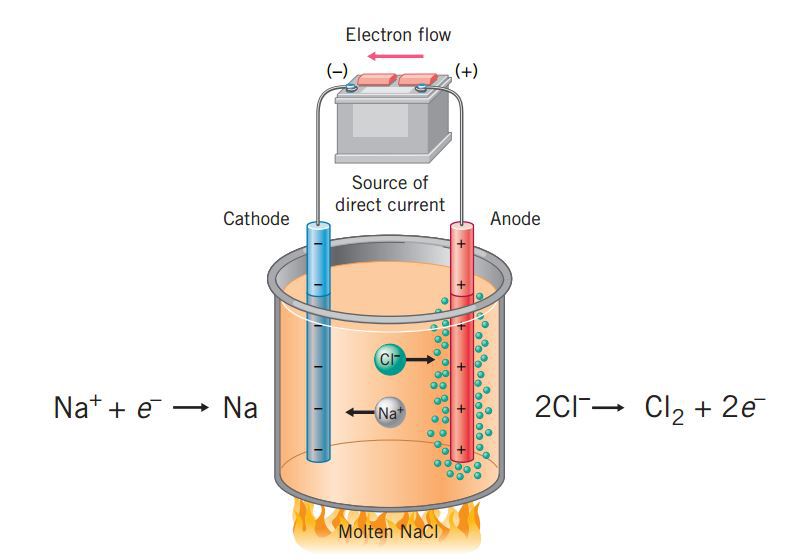
The power supply (battery) must supply a minimum of 4 V, but, in practice, the applied voltages are typically higher because of inefficiencies in the process itself. Figure 17.7.1 17.7. 1: Passing an electric current through molten sodium chloride decomposes the material into sodium metal and chlorine gas.