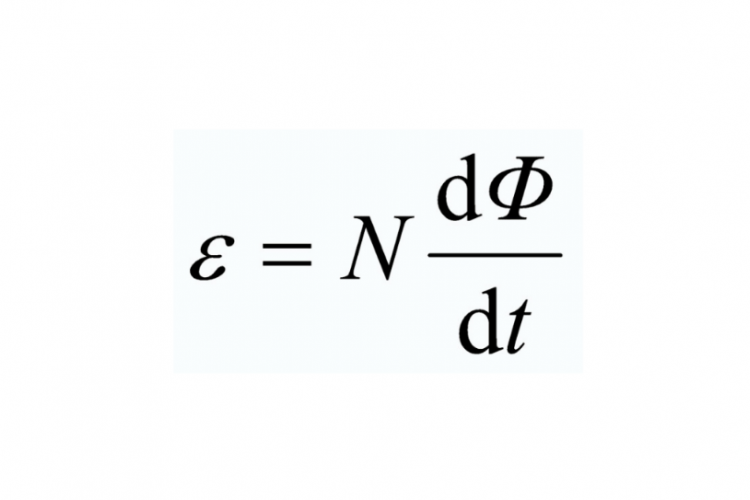
Contoh Soal Hukum Faraday I dan II Lengkap dengan Kunci Jawabannya
Hubungan rumus hukum faraday 1 dan 2: Rumus hukum faraday yang pertama dan kedua memiliki hubungan yang dinyatakan dengan rumus G = k. i. t. ME. Untuk nilai k atau tetapan Faraday dan nilai ME nya adalah: k = 196500 ME = Ar / Mrbiloks / valensi. Dengan demikian didapatkan sebuah rumus akhir dari kedua hukum faraday, yaitu: G = i x t x ME96500
What is Faraday's Law? Laws of Induction
Pengertian dan Bunyi hukum Faraday 1 dan 2☑️ Rumus (persamaan), Contoh Soal dan pembahasan hukum Faraday 1 dan 2 lengkap☑️ Seorang ilmuwan yang berasal dari Inggris bernama Michael Faraday menemukan sebuah hukum yang digunakan dalam ilmu kimia dinamakan Hukum Faraday. Hubungan antara penggunaan muatan listrik dan hasil massa zat dalam electrode dijelaskan melalui hukum ini.

Pembahasan Soal Elektrolisis Hukum Faraday 1 dan 2 YouTube
Faraday juga banyak mempopulerkan istilah-istilah kimia, seperti elektroda, elektrolit, anoda, katoda, dan sebagainya. Rumus Hukum Faraday Selain memiliki bunyi yang berbeda, hukum Faraday 1 dan 2 juga memiliki rumus yang berbeda. Adapun rumus hukum Faraday 1 dan 2 adalah sebagai berikut. Rumus Hukum Faraday 1 G ≈ Q atau G ≈ it Keterangan.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Mari kita lihat kembali Hukum Faraday 1 dan Hukum Faraday 2: Hukum Faraday 1 : w ≈ I x t. Hukum Faraday 2 : w ≈ ME. Jika digabungkan, kita peroleh w ≈ I x t x ME. Perbandingan ini menjadi persamaan dengan penambahan faktor 1/96.500, sehingga diperoleh rumus hukum faraday : w = 1/96.500 x I x t x ME. dengan w = massa zat yang dihasilkan (gram)

Foto Hukum Faraday I dan II tentang Elektrolisis Halaman 1
Pada pertemuan ini kita bahas elektrolisis - hukum faraday 1 dan 2, Michael Faraday menemukan fakta bahwa banyaknya perubahan kimia yang dihasilkan oleh arus.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Adapun rumus hukum Faraday 1 dan 2 adalah sebagai berikut. Rumus Hukum Faraday 1. Ingat, bunyi hukum Faraday 1: "Massa zat yang dilepaskan selama elektrolisis berbanding lurus dengan jumlah listrik yang digunakan" Berdasarkan bunyinya, rumus hukum Faraday 1 dapat dituliskan sebagai berikut. G ≈ Q atau G ≈ it. Keterangan: G = massa yang.

Hukum Faraday Definisi, Kegunaan dan Aplikasi Root of Science
Michael Faraday, ia adalah seorang ilmuan asal Inggris yang lahir pada 22 September 1791 di Newington Butts, Inggris. Kemudian ia dijuluki sebagai "bapak listrik", berkat usahanya listrik bisa jadi teknologi yang memiliki banyak kegunaan. Michael Faraday menjadi seorang ahli kimia dan fisika berkat mempelajari aspek kuantitatif dan.
Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Bunyi Hukum Faraday 1 dan 2 Berikut Rumusnya. Hukum Faraday dirumuskan oleh ahli kimia dan fisika asal Inggris, Michael Faraday. Di tahun 1833, Faraday menjelaskan penemuan tentang aspek kuantitatif dari elektrolisis yang akhirnya menghasilkan dua hukum elektrolisis Faraday. Dikutip dari Modul Kimia XII yang disusun oleh Arni Wiyati (2020.
Hukum Faraday 1 Amp 2 Pengertian Rumus Dan Contoh Soal Riset
Kedua hukum yang diperoleh dibagi menjadi hukum Faraday 1 dan 2. Michael Faraday (22 September 1791-25 Agustus 1867) sendiri adalah seorang ilmuwan Inggris yang mendapat julukan "bapak listrik", karena berkat usahanya listrik menjadi teknologi yang banyak gunanya. Dia mempelajari berbagai bidang ilmu pengetahuan, termasuk.

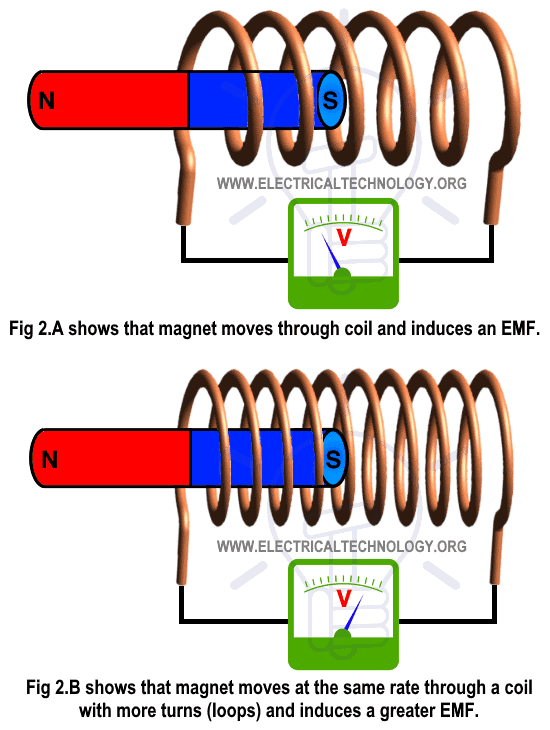
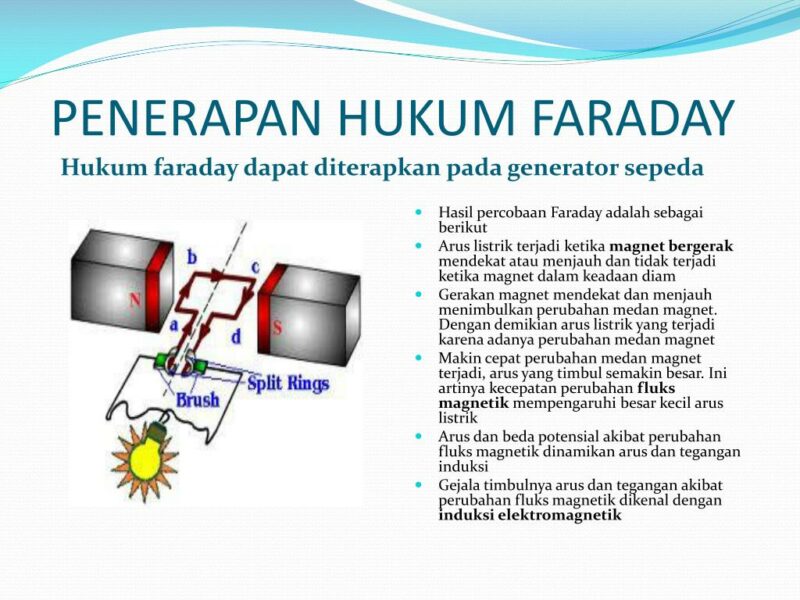
Hukum Lenz, Hukum faraday, GGL induksi dan Arus induksi induksi FISIKA
Keterangan. W : Massa zat yang dihasilkan (gram) e : Massa ekuivalen. i : Kuat arus (ampere) t : Waktu (secon). F : Tetapan Faraday = 96.500 Coulomb/mol. 𝑄=𝑖×𝑡. Contoh soal penerapan Hukum Faraday 1 adalah sebagai berikut ini: 1.Tentukan Jumlah faraday untuk mereduksi ion Ca2+ dalam bentuk leburan (Ar Ca= 40) sebanyak 12 gram.

Belajar Kimia Hukum Faraday I dan II YouTube
Contoh Soal Hukum Faraday dan Pembahasan. 1. Berapa gram kalsium yang dapat dihasilkan dari elektrolisis lelehan CaCl 2 dengan elektroda grafit selama satu jam jika digunakan arus 10 A? (A r Ca = 40) Jawab: Massa Ca yang dihasilkan dapat dihitung dengan rumus: Diketahui i = 10 A; t = 1 jam = 3.600 s.

HUKUM FARADAY I DAN II KIMIA SMA YouTube
Hukum 1 Faraday. Hukum 1 Faraday berbunyi, "Massa zat yang dihasilkan oleh suatu elektrode selama elektrolisis(W) akan berbanding lurus dengan jumlah muatan listrik yang akan digunakan (Q)".Berikut ini merupakan persamaan untuk menyatakan Hukum 1 Faraday. W ~ Q. Jumlah muatan listrik yang digunakan (Q) sama dengan hasil kali antara kuat arus listrik (i) dan selang waktu (t).

Bunyi Dan Rumus Hukum Faraday 1 Dan 2 PDF
Contoh Soal Hukum Faraday 1 Dan 2 1. Dalam sebuah percobaan fluks magnetik yang dihasilkan oleh medan magnetik B tegak lurus dengan permukaan seluas A adalah Ф. Apabila ukuran medan magnetik pada percobaan tersebut diperkecil menjadi ½ B dan luas permukaannya di perbesar menjadi 2 A. Jadi, berapakah fluks magnetik yang dihasilkan?.

Materi Hukum Faraday I Dan II PDF
Hai pengunjung! Yuk simak rumus hukum Faraday 1 dan 2 yang merupakan landasan penting dalam memahami induksi elektromagnetik. Rumus ini digunakan untuk menghitung besarnya arus dan medan magnet yang terjadi akibat perubahan fluks magnetik. Dengan memahami rumus ini, kamu akan mampu mengaplikasikannya secara efektif dalam berbagai perhitungan teknik dan ilmu pengetahuan lainnya.
/Faraday-58d1369b5f9b581d721fa176.jpg)
Induction and Faraday's Law
Kinetic energy - The type of energy an object has due to its motion.It changes whenever the speed of an object changes and the magnitude of kinetic energy possesses a quadratic relationship to its velocity, defined through the equation: Ekin=1/2m*v^2.The Faraday pointer and the device in the test tube convert kinetic energy into electricity.

Pengertian Hukum Faraday Dilengkapi Bunyi Rumus Dan Contoh Soal Riset
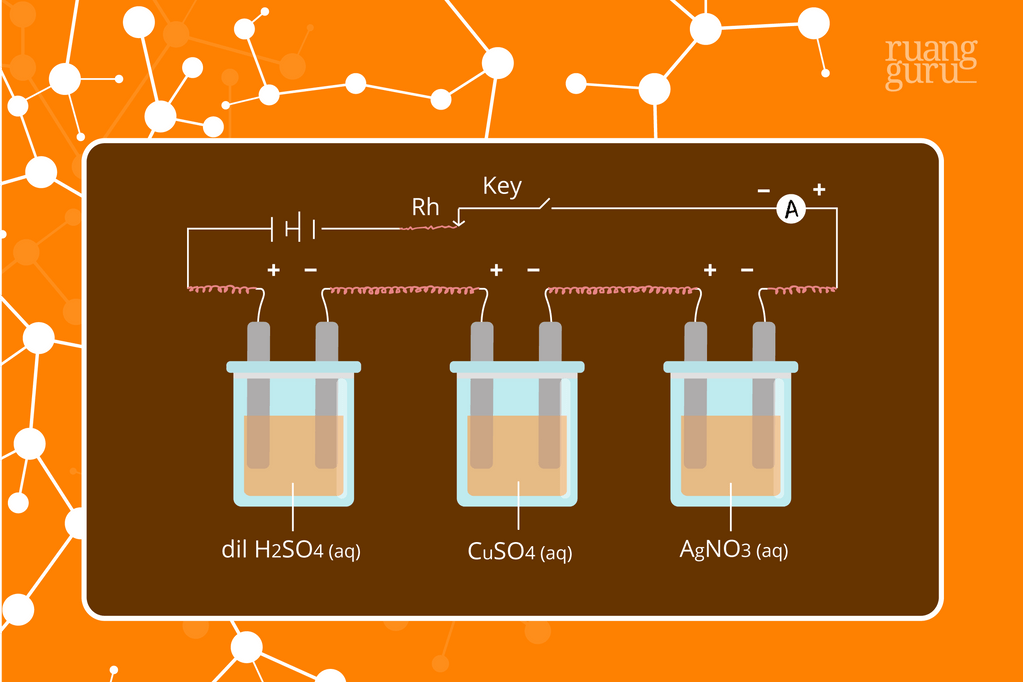
Contoh soal hukum faraday elektrolisis nomor 1 Pada elektrolisis larutan CuSO4 (Ar Cu = 63,5) dengan jumlah muatan listrik 0,4 faraday akan diendapkan logam tembaga seberat.A. 25,40 gramB. 12,70 gramC. 6,35 gramD. 2,54 gramE. 1,37 gram Pembahasan Di katode terbentuk 2 elektron (2e-) sehingga n = 2. → e = Ar n = 63,5