
Detail Contoh Senyawa Ikatan Kovalen Koleksi Nomer 7
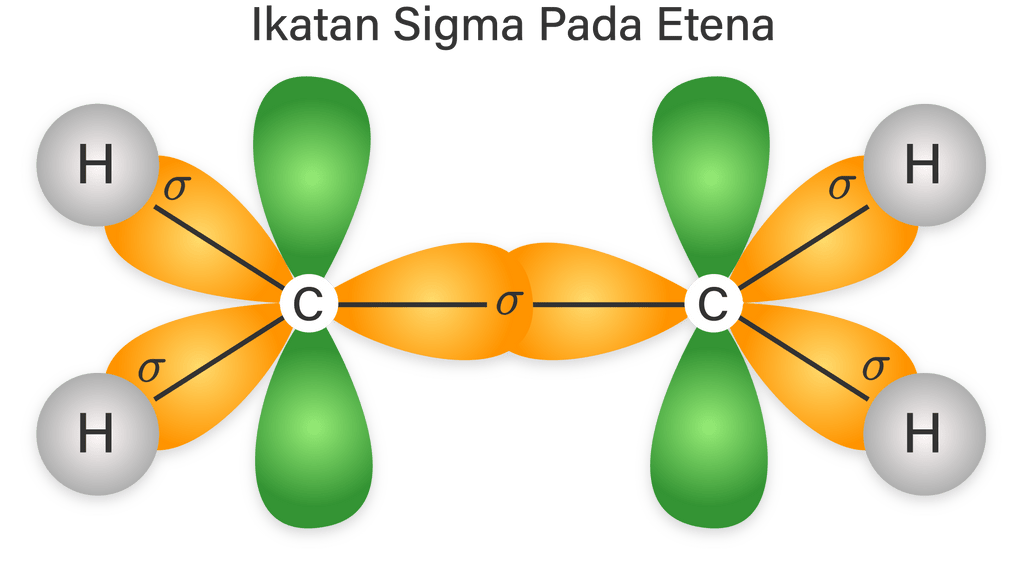
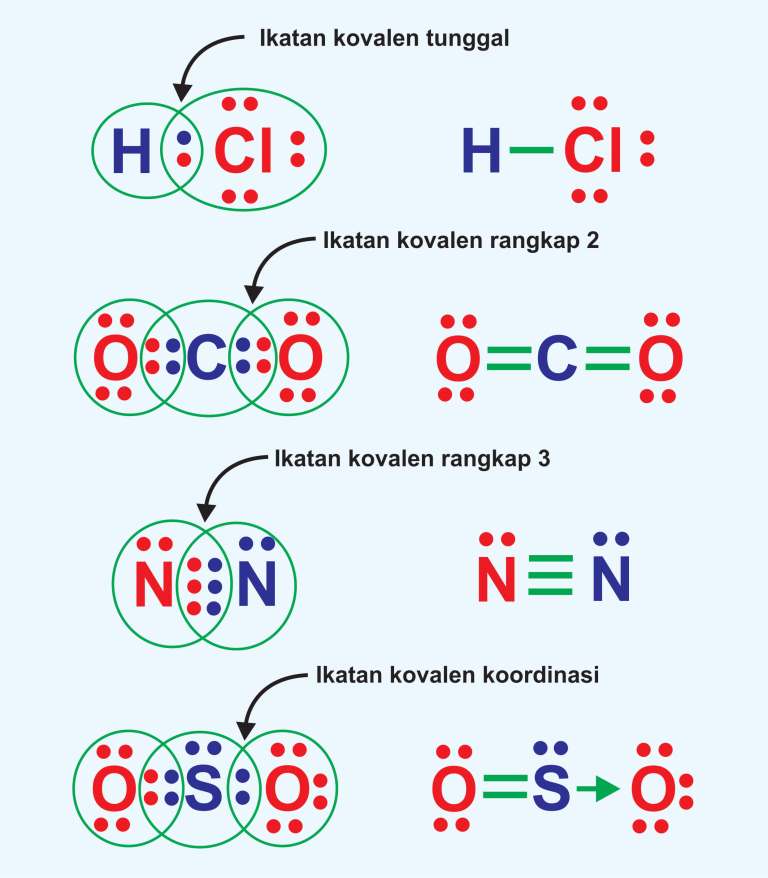
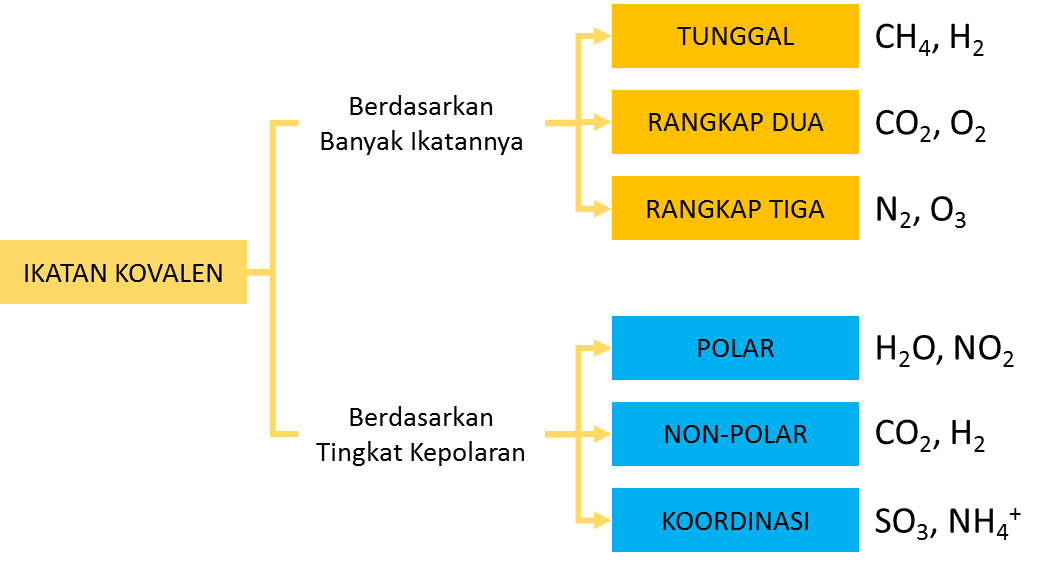
Contoh ikatan kovalen tunggal yaitu terjadi pada H-Cl, CH 4, dan lain lain. Ikatan kovalen rangkap dua; Dalam ikatan kovalen rangkap dua, terdapat dua pasang elektron yang digunakan untuk berikatan sehingga akan membentuk dua ikatan. Satu ikatan yang terbentuk merupakan ikatan sigma seperti pada ikatan kovalen tunggal.
√ Ikatan Kimia (Ikatan Ion, Ikatan Logam, Ikatan Kovalen) Blog Ilmu Pengetahuan
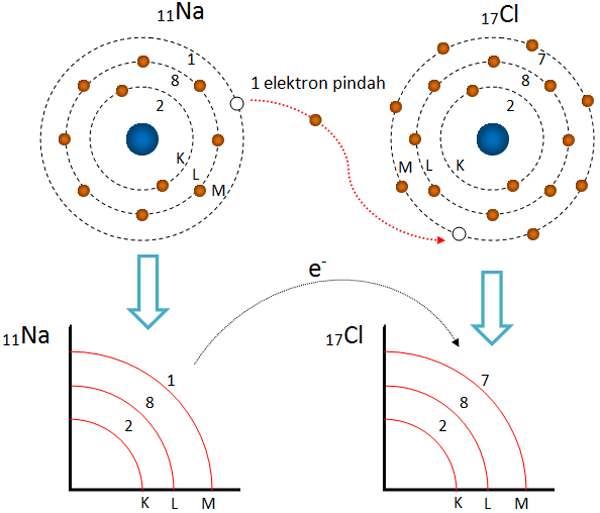
Bila Q1 dan Q2 bermuatan sama, maka keduanya akan tolak-menolak, sebaliknya bila Q1 dan Q2 bermuatan berlawanan akan terjadi tarik menarik. Ikatan kovalen terbentuk karena hampir semua unsur memiliki ruang kosong dan orbit luar berenergi rendah. Makin rendah energi suatu orbit, makin tinggi stabilitas elektron yang ada di dalamnya.

IKATAN KIMIA IKATAN KOVALEN KIMIA SMA KELAS 10 YouTube
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Ikatan kovalen akan terj.

Ikatan Kovalen
Jakarta - . Ikatan kovalen adalah ikatan yang terbentuk dari pemakaian bersama pasangan elektron antara dua atom.Pada ikatan kovalen, atom-atom yang terlibat adalah atom-atom non logam. Dijelaskan dalam Smart Book Kimia SMA/MA Kelas X, XI, XII oleh Wikke Yorita Agustin dan Ika Febriana Syafitri, ikatan kovalen terbentuk antara dua atom yang mempunyai elektronegativitas sama atau dua atom yang.

Molekul Berikut Yang Memiliki Ikatan Kovalen Rangkap 2 Adalah salah satu titik sampel
Ikatan kovalen nonpolar. Nah, bila dua buah atom atau unsur yang terikat dalam ikatan kovalen memiliki keelektronegatifan yang sama besar, maka tidak akan mengakibatkan pengutuban atau polarisasi muatan.. Sebuah senyawa terjadi ikatan kovalen polar apabila ada perbedaan kelektronegatifan yang mengakibatkan terjadinya pengutuban muatan.
Contoh Soal Essay Ikatan Kovalen Dan Pembahasannya
Jenis-Jenis atau Macam-Macam Ikatan Kimia (Ikatan Ion, Ikatan Logam, Ikatan Kovalen) 1. Ikatan Ion. Ikatan ion adalah ikatan yang terbentuk karena adanya gaya tarik menarik secara elektrostatis yang terjadi di antara ion positif dan negatif. Atom yang energi ionisasinya rendah akan mudah membentuk ion positif karena melepaskan elektron.
Jelaskan mengapa ikatan kovalen rangkap tiga lebih...
Lewat pembahasan ini, kamu bisa belajar mengenai Ikatan Kovalen. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.. oleh sebab itu ikatan ini paling mungkin terjadi bila atom-atom yang kaya elektron valensi berikatan (unsur golongan 5, 6, 7).

perbedaan senyawa ion dan kovalen dan contohnya Pippa Poole
Untuk bisa melihat bagaimana ikatan kovalen terjadi kita harus memahami terlebih dahulu konsep dari struktur Lewis. Oke, kita pahami secara seksama, yuk! Pengertian Struktur Lewis.. Setelah berikatan akan didapatkan 4 pasang elektron ikatan bersama antara atom C dan H, sehingga didapatkan struktur Lewis antara C dan H menjadi seperti berikut
Dasar teori tentang ikatan kovalen
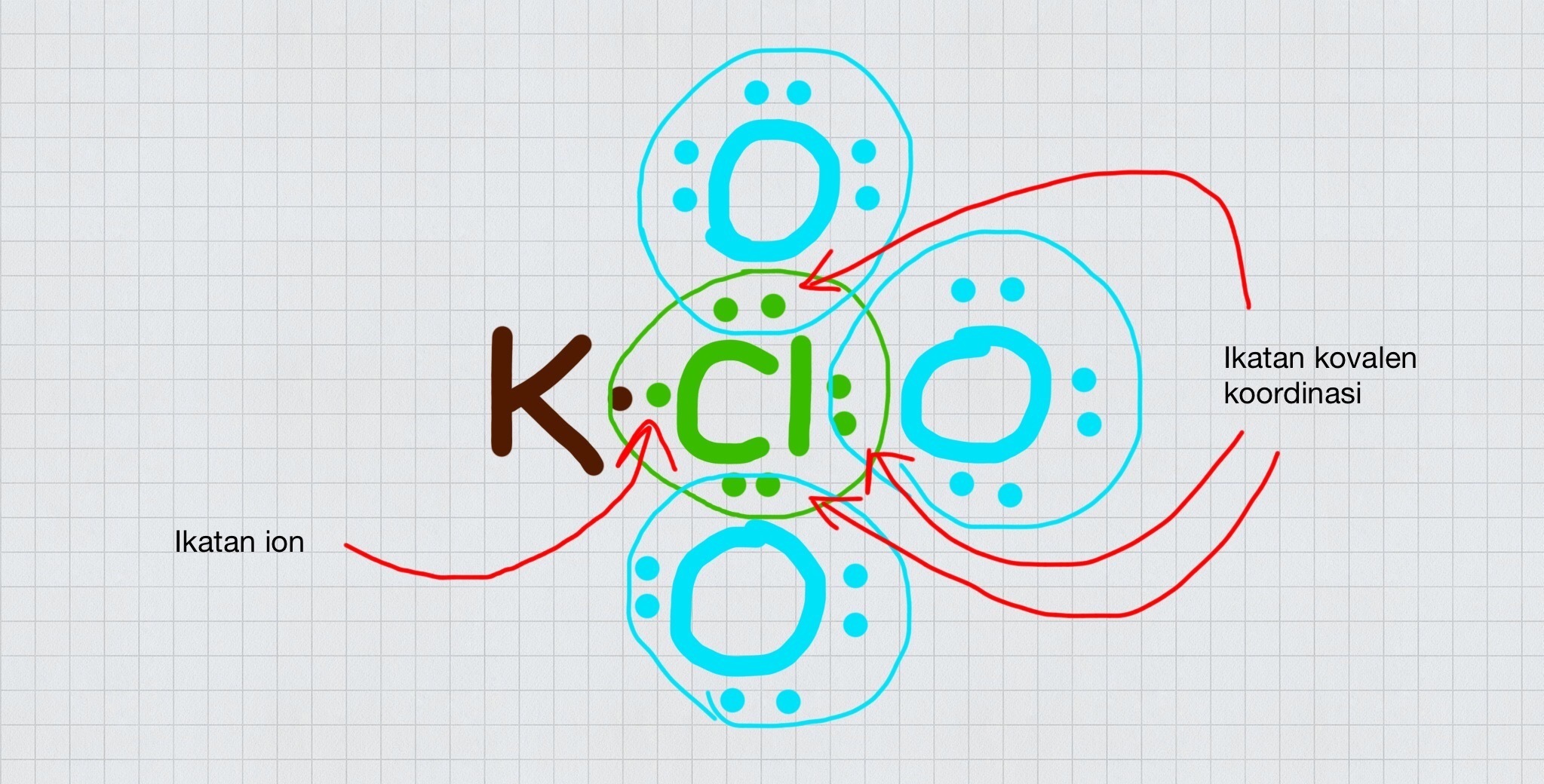
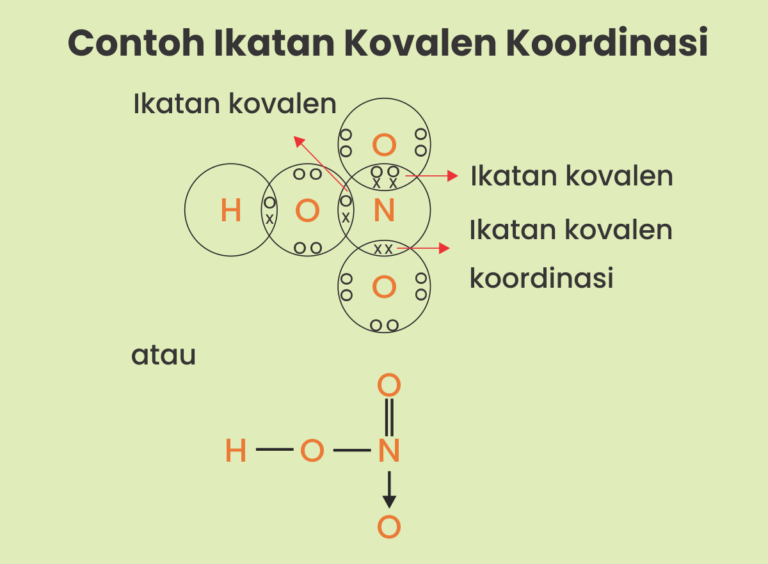
Ikatan kovalen koordinasi merupakan jenis ikatan kovalen yang dapat dibedakan dari sumber elektron dengan penggunaannya bersamaan. Ikatan ini bisa terjadi, jika terdapat satu atom yang menyerahkan pasangan elektron, sehingga atom dari pasangannya tidak akan mampu memberikan elektron. Jenis ikatan ini hanya akan terjadi pada unsur- unsur non logam.

Soal Ikatan Kovalen (Tunggal) dan Pembahasannya YouTube
Ikatan kovalen yang terbentuk pada molekul hidrogen hanya melibatkan satu pasangan elektron atau dua buah elektron, sehingga disebut juga sebagai kovalen tunggal. Contohnya terjadi pada gas fluor dan gas klor. Gas-gas yang kita temukan di alam, seperti hidrogen, nitrogen, oksigen, berada dalam bentuk molekulnya: H 2, N 2, dan O 2. Sebagai atom.

IKATAN KOVALEN & IKATAN KOVALEN KOORDINASI YouTube
Kepolaran Ikatan, Elektronegativitas, dan Momen Dipol. Ikatan kimia di mana elektron-elektron digunakan bersama secara setara dan merata, seperti pada Cl 2 dan N 2, disebut sebagai ikatan kovalen nonpolar.Ikatan di mana salah satu atom memiliki daya tarik elektron (elektronegativitas) yang lebih tinggi terhadap elektron-elektron ikatan dibanding atom lainnya, sehingga terjadi pembentukan dipol.
Ikatan Kovalen Nonpolar, Polar dan Koordinasi Siswapedia
Konsep dari ikatan kovalen yaitu terdapat atom yang sulit melepas atau menerima elektron karena memerlukan atau membebaskan energi yang besar selama proses berlangsung. Baca juga: Gas Mulia: Unsur dan Sifat-sifatnya. Karena kaidah oktet, setiap atom akan berusaha membentuk konfigurasi elektron gas mulia yang lebih stabil, atom-atom ini saling.

Ikatan Kovalen Koordinasi, Kenali Pengertian dan Contohnya
Ikatan kovalen ini dibedakan berdasarkan jumlah pasangan elektron dan kepolarannya. Agar lebih jelas, artikel ini akan membahas seputaran ikatan kovalen, mulai dari pengertian, jenis, sifat, hingga cara menggambar ikatan ini. Yuk, simak pembahasan selengkapnya di bawah ini. Daftar Isi Sembunyikan. Pengertian Ikatan Kovalen.
Ikatan Kimia Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi antara dua atau lebih atom non logam dengan pemakaian elektron secara bersama. Kedua atom yang berikatan tersebut akan tertarik pada pasangan elektron yang sama. Contohnya adalah ikatan yang terjadi pada molekul H2. Itulah mengapa ikatan kovalen disebut juga sebagai ikatan molekul.

Perbedaan Ikatan Kovalen Dengan Kovalen Koordinasi My XXX Hot Girl
Ikatan kovalen adalah jenis ikatan kimia yang terbentuk ketika dua atau lebih atom berbagi pasangan elektron valensi. Ikatan kovalen dapat bervariasi dalam kekuatan dan polaritas, tergantung pada jumlah dan jenis atom yang terlibat. Ikatan kovalen berperan penting dalam struktur dan fungsi molekul organik dan anorganik. Untuk mempelajari lebih lanjut tentang ikatan kovalen dan fenomena terkait.

X.2.f. Ikatan Kovalen Tunggal, Rangkap Dua, dan Rangkap Tiga (Teori) YouTube
Sedangkan bila pasangan elektron yang akan digunakan ini berasal dari salah satu atom yang berkaitan disebut dengan ikatan kovalen koordinasi atau kovalen dativ.. Ikatan kovalen terjadi akibat ketidakmampuan salah satu atom yang akan berikatan untuk melepaskan elektron menjadi ion positif khususnya terjadi pada atom nonlogam yang cenderung.