Dasar teori tentang ikatan kovalen
Dalam kimia, ikatan kovalen koordinasi ditunjukkan dengan anak panah (→) yang arahnya menunjuk arah dari atom donor menuju ke atom reseptor. Baca juga: Jenis-jenis Ikatan Kovalen. Senyawa SO3. Atom 16S memiliki konfigurasi elektron 2 8 6 sehingga elektron valensinya 6. Atom 8O memiliki konfigurasi elektron 2 6 sehingga elektron valensinya 6

Ikatan Kovalen Koordinasi KIMIA KELAS 10 YouTube
Ikatan kovalen koordinasi terjadi ketika elektron-elektron yang digunakan untuk berikatan berasal dari salah satu unsur yang berikatan. Contoh ikatan kovalen koordinasi terdapat pada ion-ion dan senyawa-senyawa berikut. NH4+, HNO3, SO3, H2SO4, H3O+, H3NBF3, POCl3, HClO4, SO2Br2, N2O. 1. Ikatan Kovalen Koordinasi NH4+ 2. Ikatan Kovalen Koordinasi HNO3 3.

Animasi Ikatan Kovalen Koordinasi YouTube
Ikatan kovalen koordinasi ditunjukkan oleh nomor. (nomor atom H = 1; S = 16; O = 8) A. 1. B. 2. C. 3. D. 4. E. 5. Jawaban: D. Pembahasan: Ikatan kovalen koordinasi adalah pemakaian elektron bersama yang hanya berasal dari salah satu atom. Pada struktur Lewis H 2 SO 4 di atas, terlihat bahwa ikatan nomor 4 hanya berasal dari atom S tetapi.

ikatan kovalen koordinasi dutunjukan oleh nomor Brainly.co.id
Contoh ikatan kovalen koordinasi. 1. Senyawa SO3. Atom 16S memiliki konfigurasi elektron 2 8 6. Jadi, atom ini memiliki enam elektron valensi. Atom 8O memiliki konfigurasi elektron 2 6. Untuk membentuk senyawa SO3 yang memenuhi kaidah oktet, sepasang elektron dari atom S akan berikatan dengan sepasang elektron dari atom O sehingga membentuk.

Cara mudah menentukan Ikatan Kovalen Koordinasi YouTube
Berikut ini akan dijelaskan tentang ikatan kovalen koordinasi, ikatan logam, pengertian ikatan logam, kovalen koordinasi, contoh ikatan kovalen koordinasi,. Jadi, ikatan kovalen koordinasi ditunjukkan oleh anak panah nomor 3. Contoh 2: Tuliskan struktur Lewis dari senyawa SO3 dan tunjukkan bagian mana yang merupakan ikatan kovalen koordinasi.

Menentukan Ikatan Kovalen Koordinasi YouTube
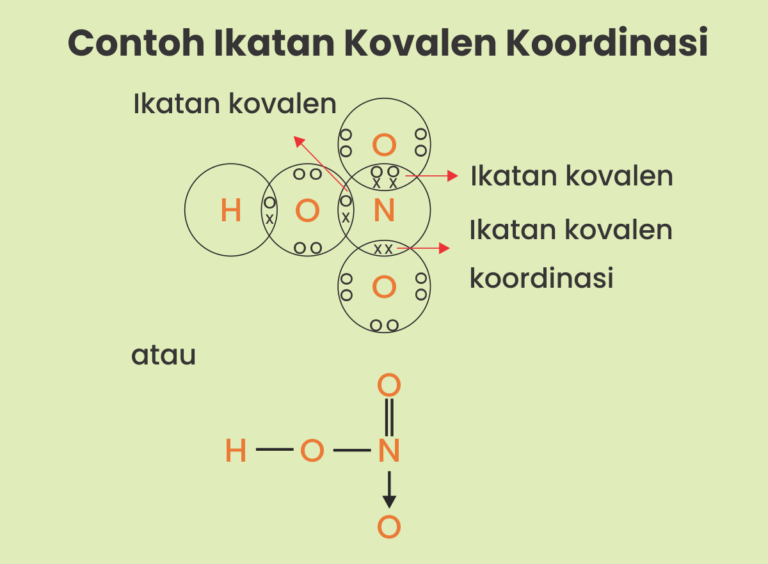
Dari gambar tersebut yang merupakan ikatan kovalen koordinasi adalah no (1) karena hanya inti hidrogen tanpa elektron yang berikatan dengan unsur N, jadi unsur hidrogen menggunakan dua elektron N secara bersamaan. Nomor (2) menunjukkan ikatan ion, karena mengikat unsur logam natrium dan unsul klorin yang bersifat non logam.

Perhatikan struktur lewis molekul HNO3 berikut. H 1 O 2 N...
Nomer (1) adalah ikatan kovalen koordinat karena hanya inti hidrogen tanpa elektron yang berikatan dengan unsur N, jadi unsur hidrogen menggunakan dua elektron N secara bersamaan. Nomer (2) menunjukkan ikatan ion, karena mengikat unsur logam natrium dan unsul klorin yang bersifat non logam. Nomor (3) menunjukkan ikatan kovalen antar unsur H dan N.

IKATAN KOVALEN & IKATAN KOVALEN KOORDINASI YouTube
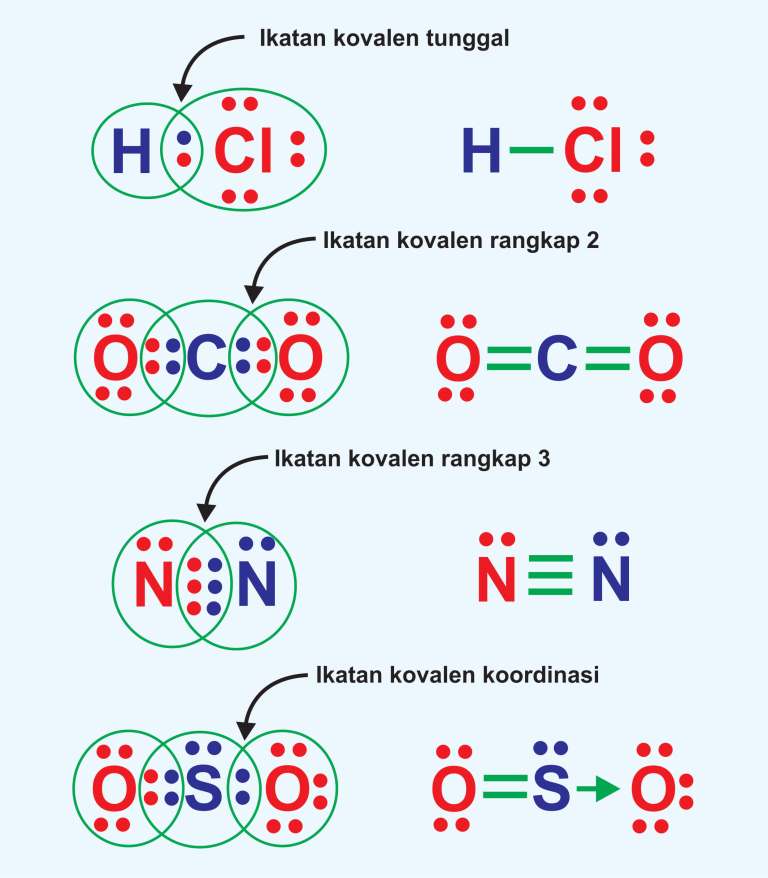
Hal ini kemudian dinamakan sebagain ikatan kovalen nonpolar. Contoh ikatan kovalen nonpolar: I 2, Br 2, H 2, N 2. Misalnya pada I 2 dimana elektron digunakan oleh dua inti atom I. Oleh karena keelektronegatifannya sama besar, maka tidak terjadi pengutuban atau polarisasi. Perhatikan gambar di bawah ini. contoh ikatan kovalen non polar. b.

Contoh Soal Ikatan Kovalen Koordinasi Dan Pembahasannya Gif Auto My XXX Hot Girl
Ikatan kovalen koordinasi adalah ikatan yang terbentuk karena adanya pemakaian pasangan elektron bersama yang berasal dari satu atom. Dalam soal ini, yang memberikan pasangan elektron untuk digunakan bersama adalah atom S dimana pasangan elektronnya ditunjuk oleh nomor 4.

Cara Identifikasi Keberadaan Ikatan Kovalen Koordinasi pada Suatu Molekul Serba Ada
Ikatan kovalen koordinasi ditunjukkan oleh nomor. Ikatan kovalen koordinasi adalah ikatan kovalen yang terjadi sebagai akibat pemakaian bersama pasangan elektron oleh atom-atom yang berikatan. Artinya, pasangan elektron yang digunakan oleh atom-atom yang berikatan berasal dari salah satu atom saja. Pada soal, diketahui bahwa atom-atom yang.
Ikatan Kovalen Nonpolar, Polar dan Koordinasi Siswapedia
Ikatan kovalen koordinasi, juga disebut sebagai ikatan datif, ikatan dipolar, atau ikatan koordinat adalah suatu jenis ikatan kovalen dua pusat, dua elektron yang kedua elektron tersebut berasal dari atom yang sama. Pengikatan ion logam pada ligan melibatkan jenis interaksi ini. Jenis pengikatan ini menjadi hal yang penting pada teori asam-basa Lewis.. Ikatan koordinasi umum ditemukan pada.
WANIBESAK Ikatan Kovalen atau Covalent Bond
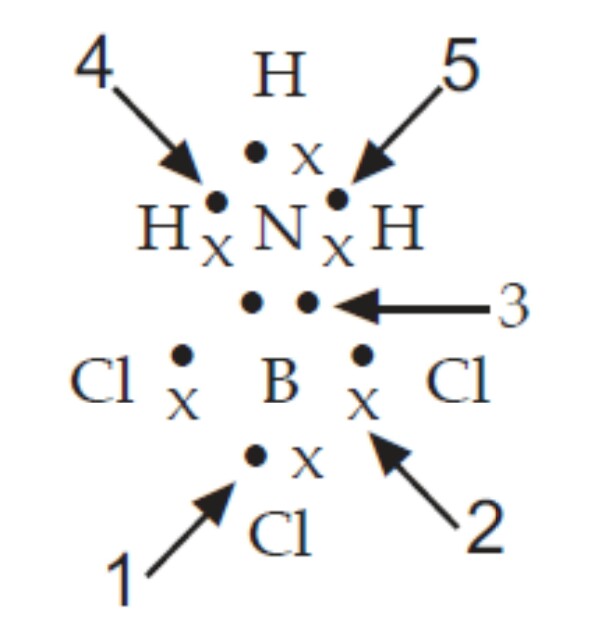
Ikatan kovalen koordinasi adalah ikatan kovalen dimana pasangan elektron yang digunakan untuk berikatan berasal hanya dari salah satu atom berikatan. Berdasarkan gambar dapat diketahui bahwa elektron ikatan nomor 1, 2, 3, dan 5 berasal dari kedua atom yang berikatan (ditandai dengan simbol elektron yang berbeda), sedangkan elektron ikatan nomor.

Perhatikan rumus struktur Lewis senyawa hclo4 berikut ikatan kovalen koordinasi ditunjukkan oleh
Jelaskan pengertian ikatan kovalen! Jawaban: Ikatan kovalen adalah ikatan yang terjadi karena pemakaian bersama pasangan elektron oleh dua atom yang berikatan. Soal No. 12. Sebutkan sifat-sifat umum senyawa kovalen! Jawaban: Terbentuk dari atom non logam dengan atom non logam; Pada suhu kamar berwujud gas, sebagian ada yang berwujud cair dan padat

ikataan kovalen koordinasi ditunjukkan oleh pasangan nomor. . .a. 1) & 2)b. 1) &5)c. 2
Sedangkan nomor 4 merupakan pasangan elektron bebas dari atom . Dan nomor 2 merupakan ikatan kovalen koordinasi karena atom nitrogen menyumbangkan ke dua elektronnya kepada atom boron, sehingga atom nitrogen dan atom boron dapat berikatan. Maka, ikatan kovalen koordinasi ditunjukkan oleh ikatan pada nomor 2.

Apakah yang dimaksud dengan ikatan kovalen?
Ikatan kovalen koordinasi adalah ikatan kovalen dimana pasangan elektron yang dipakai bersama-sama hanya disumbangkan oleh satu atom saja, sedangkan atom yang lainnya tidak menyumbang elektron. Ikatan kovalen koordinasi terjadi jika salah satu atom mempunyai pasangan elektron bebas atau PEB.. Ikatan kovalen koordinasi ditunjukkan oleh nomor

Ikatan Kovalen Adalah
Dalam molekul NH 3 terdapat sepasang elektron yang tidak digunakan (elektron bebas) sehingga disebut Pasangan Elektron Bebas (PEB). Tiga pasang elektron yang digunakan bersama oleh atom N dan atom H disebut Pasangan Elektron Ikatan (PEI). 2. Struktur Lewis Molekul H 2 O. Atom 8 O memiliki konfigurasi elektron 8 O:2, 6.