struktur lewis ikatan kovalen
Contoh ikatan kovalen koordinasi. 1. Senyawa SO3. Atom 16S memiliki konfigurasi elektron 2 8 6. Jadi, atom ini memiliki enam elektron valensi. Atom 8O memiliki konfigurasi elektron 2 6. Untuk membentuk senyawa SO3 yang memenuhi kaidah oktet, sepasang elektron dari atom S akan berikatan dengan sepasang elektron dari atom O sehingga membentuk.

Jumlah ikatan kovalen koordinat yang terdapat pada senyawa h2 so4 adalah Brainly.co.id
Ikatan kovalen adalah ikatan yang terbentuk dari pemakaian bersama pasangan elektron oleh dua atau lebih atom non logam. Ikatan kovalen ini dibedakan berdasarkan jumlah pasangan elektron dan kepolarannya. Agar lebih jelas, artikel ini akan membahas seputaran ikatan kovalen, mulai dari pengertian, jenis, sifat, hingga cara menggambar ikatan ini.
Apakah H 2 SO 4 termasuk senyawa kovalen dan dapat...
Ikatan kovalen koordinasi merupakan jenis ikatan kovalen yang dapat dibedakan dari sumber elektron dengan penggunaannya bersamaan. Ikatan ini terjadi apabila ada satu atom yang memberikan pasangan elektron. Sehingga atom pasangannya tidak dapat memberikan elektron. Jenis ikatan ini hanya akan terjadi pada unsur-unsur non logam.

IKATAN KOVALEN & IKATAN KOVALEN KOORDINASI YouTube
Ikatan kovalen koordinasi terjadi jika salah satu atom (biasanya atom pusat) memberikan elektron untuk berikatan dan dipakai bersama-sama dalam ikatan. Bisa dilihat pada nomor 4 dari elektron pasangan, bahwa S memberikan sepasang elektron sedangkan O menerima elektron dan dipakai bersama untuk digunakan berikatan.

Apakah yang dimaksud dengan ikatan kovalen?
Contohnya adalah BF3NH3 molekul HNO3, SO3, NH4Cl, dan H2SO4. Gambar dari ikatan kovalen koordinasi adalah. 5B = 1s2 2s2 2p1. 9F = 1s2 2s2 2p5. 7N = 1s2 2s2 2p3. fb Whatsapp Twitter LinkedIn. Tags Atom, ilmu kimia; Related Posts. Asam Salisilat: Pengertian - Manfaat dan Efek Sampingnya;

Ikatan Kovalen Koordinasi
Contoh ikatan kovalen jenis ini adalah pembentukan senyawa HCl dan CH4. a. Pembentukan HCl. Konfigurasi elektron 1H : 1s1 sehingga elektron valensinya = 1. Untuk mencapai konfigurasi elektron yang stabil (sesuai kaidah duplet) diperlukan 1 elektron. Konfiguarsi elektron 17Cl adalah 1s2 2s2 2p6 3s2 3p5 sehingga CI dan mempunyai elektron valensi = 7.

Cara mudah menentukan Ikatan Kovalen Koordinasi YouTube
Ikatan kovalen koordinasi. Ikatan kovalen koordinasi, [1] juga disebut sebagai ikatan datif, [2] ikatan dipolar, [3] atau ikatan koordinat [4] adalah suatu jenis ikatan kovalen dua pusat, dua elektron yang kedua elektron tersebut berasal dari atom yang sama. Pengikatan ion logam pada ligan melibatkan jenis interaksi ini. [5]

Animasi Ikatan Kovalen Koordinasi YouTube
Ikatan kovalen koordinasi adalah ikatan kovalen dimana pasangan elektron yang dipakai bersama berasal dari salah satu atom yang berikatan. Proses pembentukan ikatan kovalen koordinasi dapat kita lihat dalam contoh berikut: NH3BF3 Ikatan kovalen tidak hanya ikatan kovalen koordinasi. Melainkan ada ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.

Ikatan Kovalen H2So4
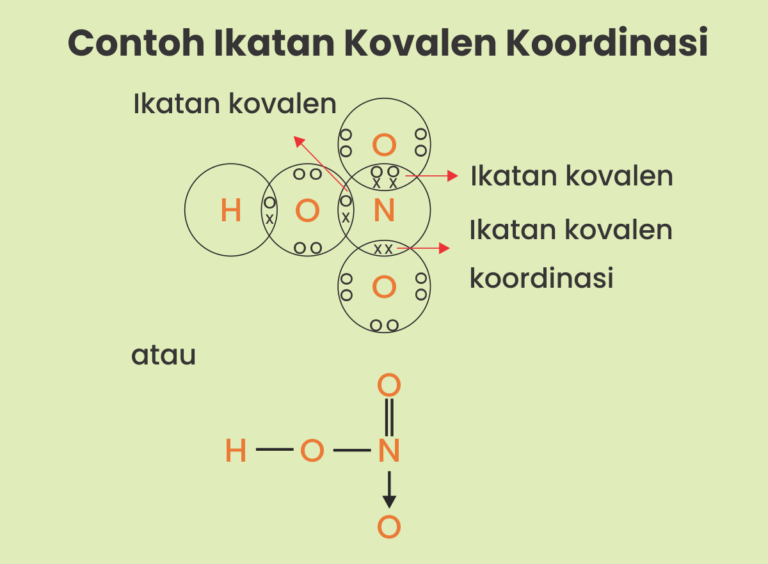
Contoh senyawa yang memiliki ikatan kovalen koordinasi adalah HNO3, NH4Cl, SO3, dan H2SO4. Ciri dari ikatan kovalen koordinasi adalah pasangan elektron bebas dari salah satu atom yang dipakai secara bersama-sama seperti pada contoh senyawa HNO3 berikut ini. Tanda panah ( --->) menunjukkan pemakaian elektron dari atom N yang digunakan secara.

Perbedaan Ikatan Kovalen Dengan Kovalen Koordinasi My XXX Hot Girl
Basa Lewis yang memiliki pasangan elektron bebas menyumbang elektronnya kepada Asam Lewis. seperti NH3 terhadap ion H+ membentuk NH4+. contoh2 diatas H2SO4, HNO3 dsb bukan merupakan ikatan KOvalen koordinasi. ikatan kovalen koordinasi umum nya terjadi senyawa kompleks koordinasi seperti ion Fe2+ dengan Ligand H2O membentuk [Fe(H2O)6]2+

Materi Kimia kelas 10 Ikatan Kovalen Koordinasi dan Penyimpangan Kaidah Oktet _ Struktur SO3
Ada tiga jenis ikatan Kimia, yaitu ikatan kovalen, ikatan logam dan ikatan ion. Sementara itu, dalam membentuk ion, suatu atom akan melepas atau mengikat elektron. Atom-atom yang mempunyai energi ionisasi rendah, misalnya atom-atom dari unsur golongan IA dan IIA dalam sistem periodik unsur akan mempunyai kecenderungan untuk melepaskan elektronnya.

Ikatan Kovalen Koordinasi YouTube
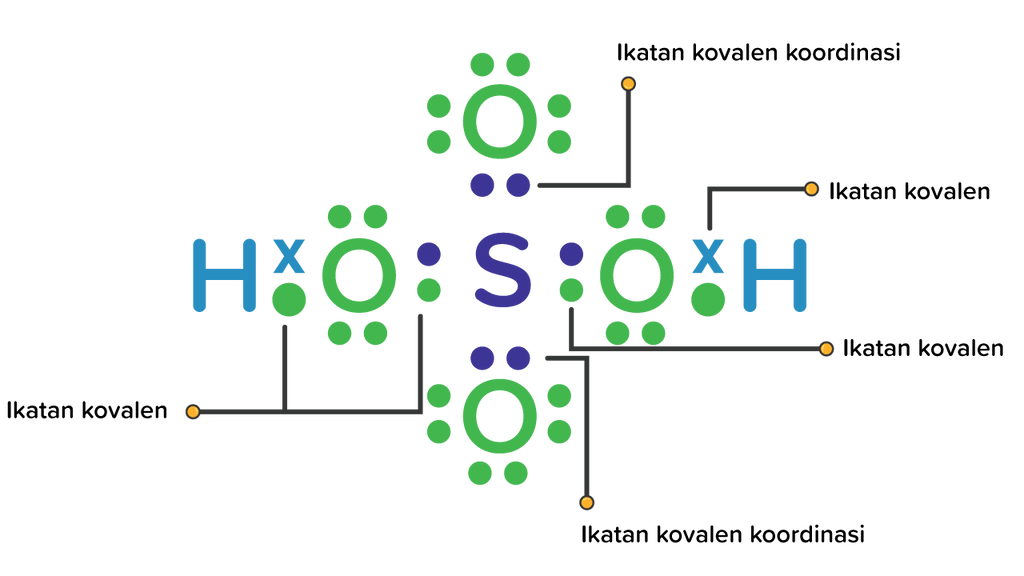
Ikatan yang membentuk H2SO4 disebut ikatan kovalen koordinatif karena ikatan yang terbentuk merupakan pasangan elektron bersama dari satu atom (terbentuk oleh ikatan homopolar dan heteropolar). Asam sulfat ini dapat disebut asam tetraoksosulfat atau hidrogen tetraoksosulfat (IV). Ini pertama kali diamati pada Abad Pertengahan Muslim, ketika.

Cara Identifikasi Keberadaan Ikatan Kovalen Koordinasi pada Suatu Molekul Serba Ada
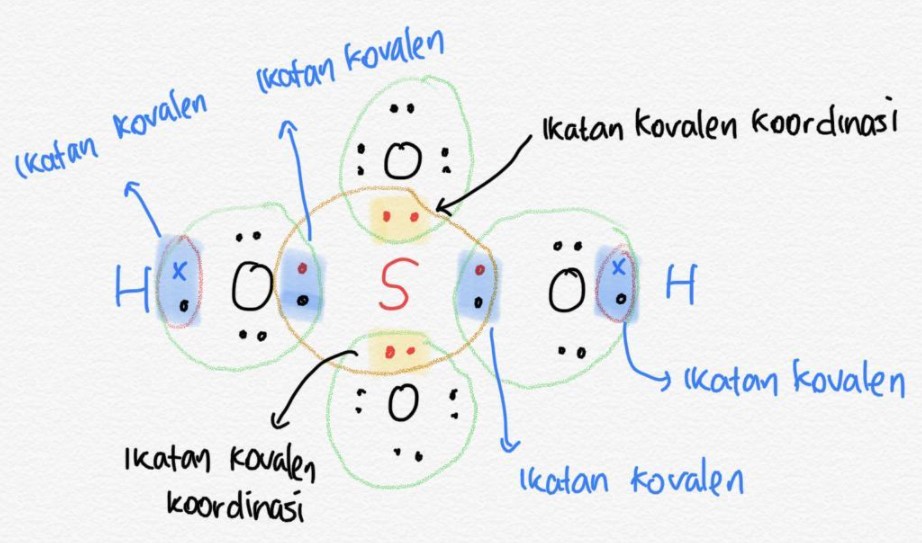
Ikatan kovalen koordinasi adalah ikatan yang terbentuk karena adanya pemakaian pasangan elektron bersama yang berasal dari satu atom. Dalam soal ini, yang memberikan pasangan elektron untuk digunakan bersama adalah atom S dimana pasangan elektronnya ditunjuk oleh nomor 4.

Menentukan Ikatan Kovalen Koordinasi YouTube
Ikatan kovalen koordinasi terjadi ketika elektron-elektron yang digunakan untuk berikatan berasal dari salah satu unsur yang berikatan. Contoh ikatan kovalen koordinasi terdapat pada ion-ion dan senyawa-senyawa berikut. NH4+, HNO3, SO3, H2SO4, H3O+, H3NBF3, POCl3, HClO4, SO2Br2, N2O. 1. Ikatan Kovalen Koordinasi NH4+ 2. Ikatan Kovalen Koordinasi HNO3 3.

Ikatan Kovalen Koordinasi, Kenali Pengertian dan Contohnya
Atom S sebagai atom pusat akan memberikan 2 pasangan elektronnya kepada masing-masing atom O untuk pemakaian bersama. Ikatan inilah yang disebut ikatan kovalen koordinasi, yaitu pemakaian elektron bersama yang hanya diberikan oleh 1 atom. Jadi, ikatan yang terjadi pada H2SO4 adalah 4 ikatan kovalen tunggal dan 2 ikatan kovalen koordinasi.
Ikatan Kovalen Nonpolar, Polar dan Koordinasi Siswapedia
Ikatan kovalen koordinasi. Ikatan kovalen koordinasi adalah ikatan yang memakai pasangan elektron bersama, namun elektronnya hanya berasal dari salah satu atom. Contohnya adalah pembentukan ozon atau O3. Agar semua atom dapat memenuhi aturan oktet, maka salah satu atom yang berada di tengah harus menyumbangkan dua elektronnya untuk digunakan.