Teori Asam Basa Arrhenius bronsted lowry Larutan Asam Basa YouTube
Terdapat beberapa karakteristik khas yang membedakan asam dan basa menurut teori Bronsted-Lowry: 1. Asam: - Asam dapat melepaskan ion H+. - Asam bersifat korosif dan dapat menyebabkan iritasi pada kulit. - Contoh asam umum meliputi asam klorida (HCl), asam sulfat (H2SO4), dan asam asetat (CH3COOH). 2.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
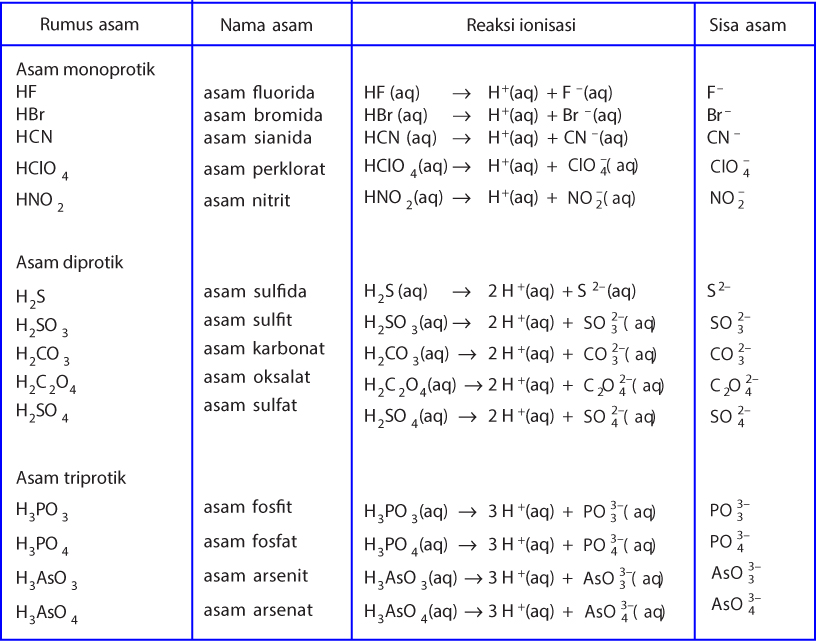
Penjelasan Lengkap: jelaskan pengertian asam basa menurut arrhenius bronsted lowry dan lewis 1. Svante Arrhenius mengembangkan teori Asam Basa Arrhenius pada tahun 1887 yang menyatakan bahwa asam adalah senyawa yang menghasilkan ion hidrogen (H+) saat larut dalam air, sedangkan basa adalah senyawa yang menghasilkan ion hidroksida (OH-) saat larut dalam air.
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
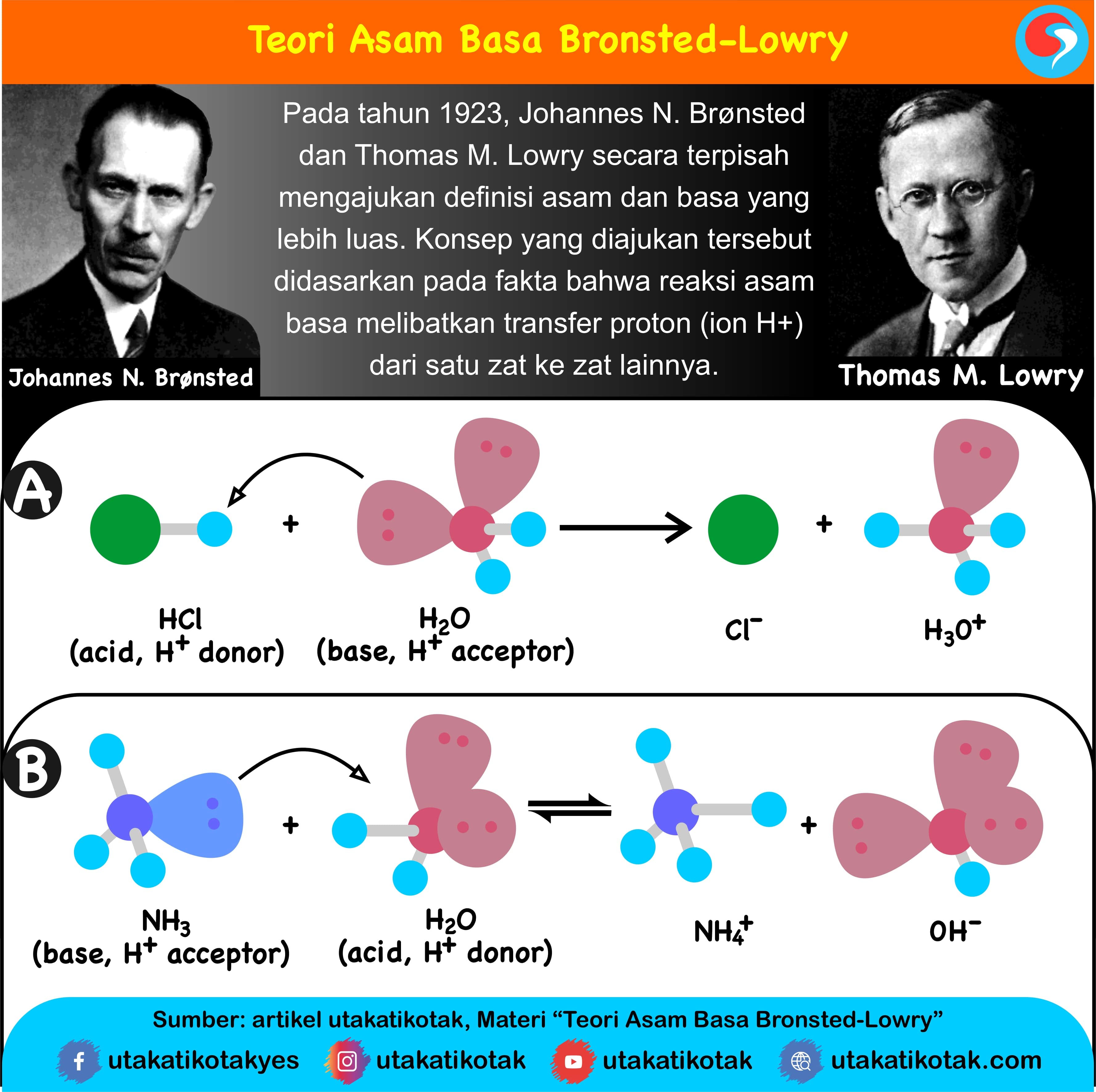
Bronsted-Lowry also states that if an acid gives protons (H+), then the rest of the acid has the ability to act as a base. The rest of the acid is expressed as conjugated bases. Similarly, for bases, if a base can receive protons (H+), then the substance formed has the ability as an acid called conjugated acid.

Teori Asambasa BronstedLowry YouTube
Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima (penerima donor) proton. Dilansir dari Khan Academy , asam mengandung hidrogen yang dapat berdisosiasi menjadi H+, sedangkan basa harus memiliki setidaknya satu pasang elektron bebas untuk dapat menerima donor.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Teori Bronsted-Lewry disebut juga dengan pasangan asam-basa konjugasi. Menurut Lowry, asam dan basa hanya terionisasi di dalam air saja. Hal ini dikarenakan air bisa menarik ion H+ dan membentuk ion hidronium dan air melepas ion H- sehingga membentuk ion hidroksida. Baca juga: Jenis-Jenis Indikator Asam Basa.

Teori Asam Basa
Contoh Penggunaan Konsep Asam dan Basa Menurut Bronsted Lowry dalam Kehidupan Sehari-hari. Konsep asam dan basa menurut Bronsted Lowry memiliki banyak contoh penggunaan dalam kehidupan sehari-hari. Salah satu contoh yang paling umum adalah dalam pembuatan dan penggunaan produk-produk kimia seperti deterjen, sabun, dan produk pembersih lainnya.

Teori Asam Basa
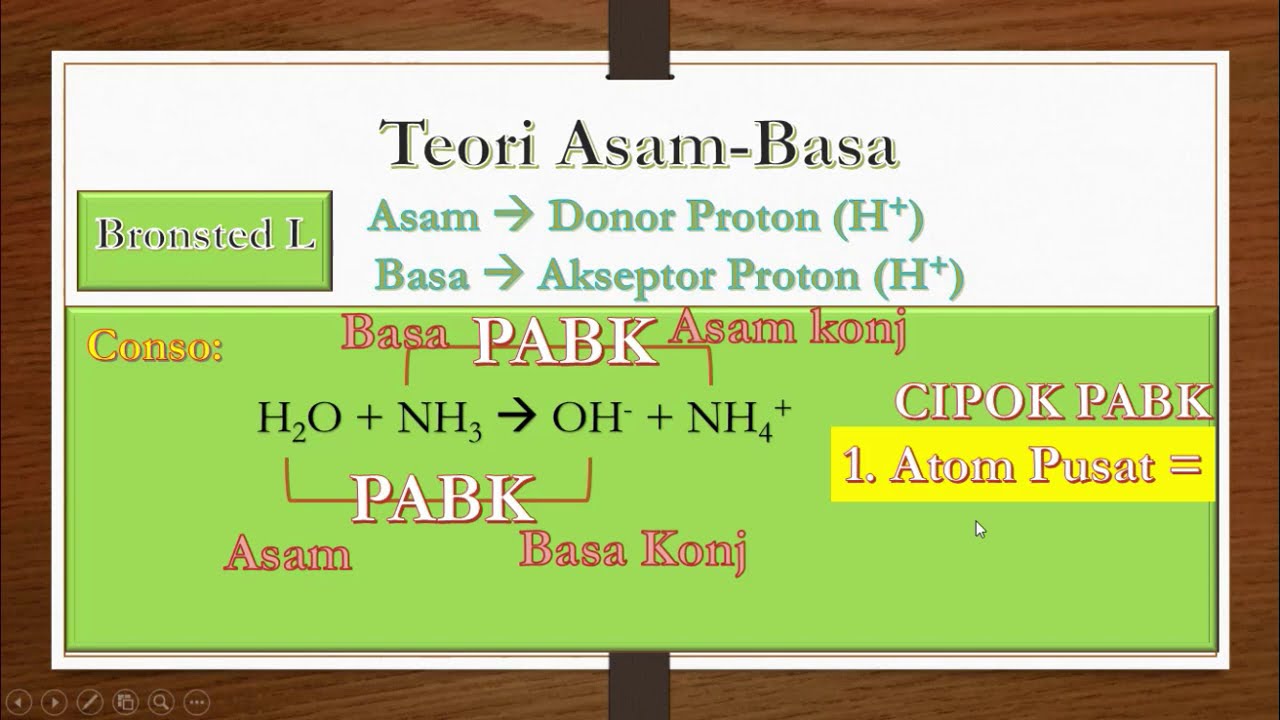
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Teori Asam Basa Bronsted Lowry YouTube
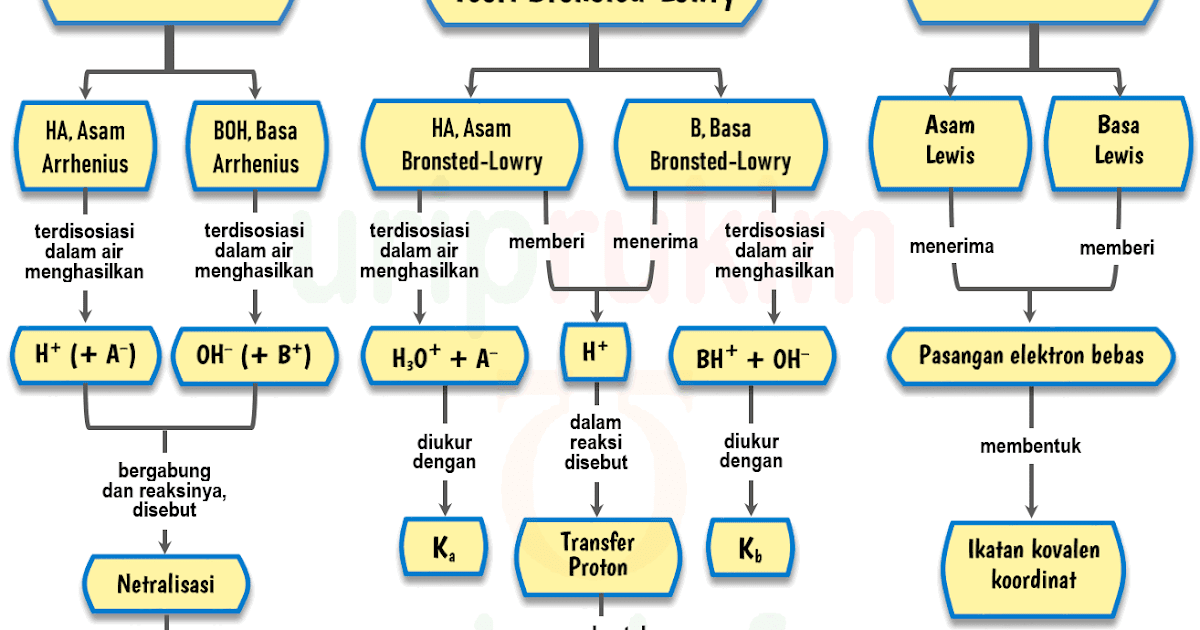
Teori Bronsted-Lowry. Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923. Menurut Bronsted-Lowry, asam didefinisikan sebagai senyawa yang dapat mendonorkan proton (H+), sedangkan basa adalah senyawa yang dapat menerima proton (H+).

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Tetapi, tidak seluruh basa Bronsted Lowry adalah basa dari Arrhenius. Berikut beberapa contoh dari reaksi asam basa dengan pelarut lain selain air pada fase gas. Salah satu contohnya adalah reaksi yang terjadi antara HCl dan NH3. Pada contoh di atas dapat dilihat bahwa reaksi asam basa Bronsted Lowry ada dua pasangan asam basa.
Teori Asam dan Basa Menurut BronstedLowry
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Reaksi ionisasi basa Arrhenius . 2. Teori Asam Basa Bronsted- Lowry. Pada tahun 1923 Johannes N. Bronsted dan Thomas M. Lowry mengajukan konsep asam basa berdasarkan pemindahan proton (H +) Berikut ini asam basa menurut Bronsted-Lowry: Asam adalah spesi yang dapat memberikan proton atau donor proton (H +)

Menentukan Asam Basa Konjugat BronstedLowry YouTube
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Menurut Lewis, asam merupakan akseptor pasangan elektron dan basa merupakan pendonor pasangan elektron. Teori ini juga diklaim memiliki kelebihan dalam mengidentifikasi reaksi asam-basa yang berada dalam benda padat, gas, dan medium pelarut lain (bukan air biasa), serta tidak melibatkan transfer proton (teori Bronsted-Lowry).
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
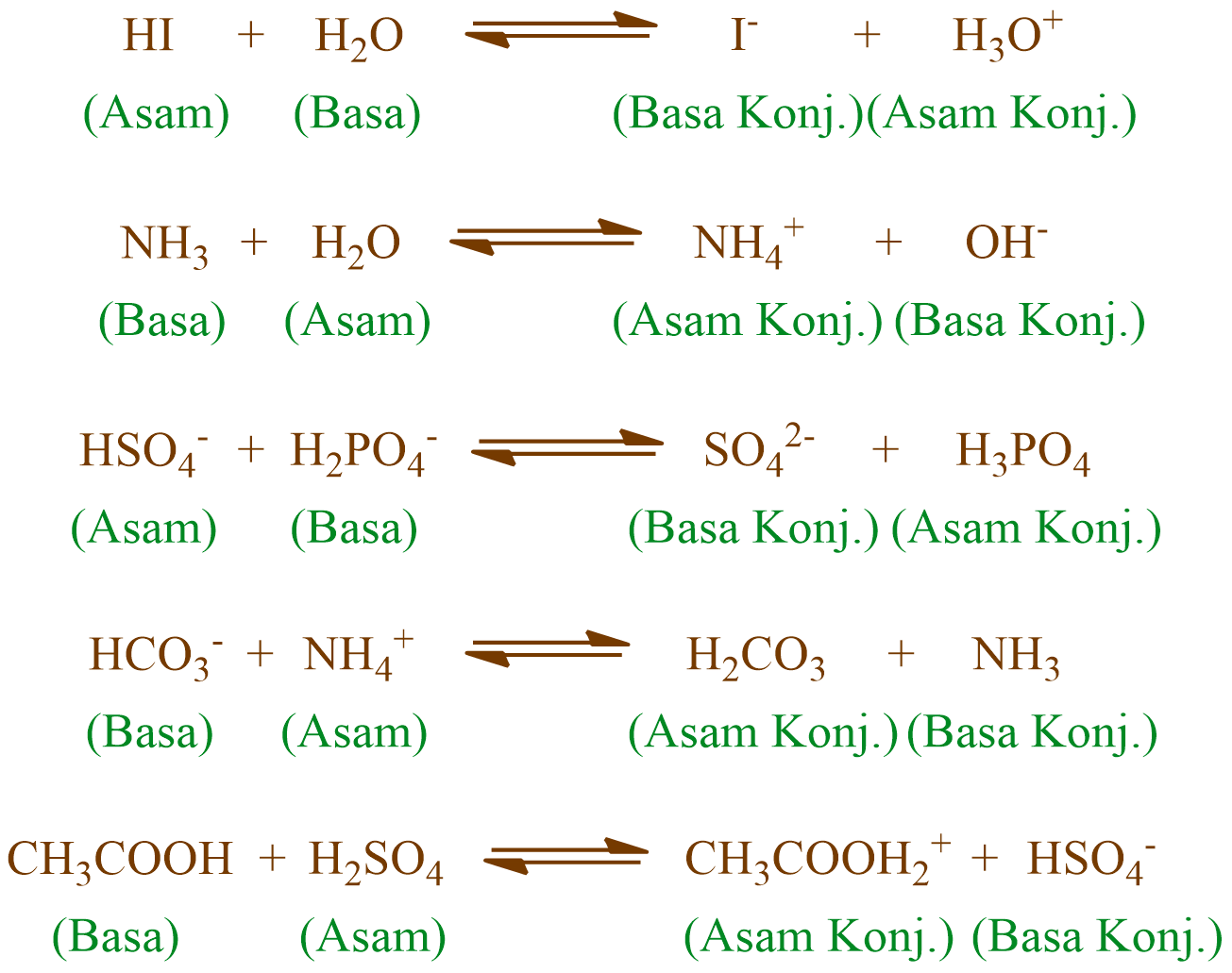
Konsep mudah belajar teori asam basa Bronsted-Lowry . dimana asam adalah pemberi proton . sedangkan Basa adalah penerima proton. terdiri dari asam basa konj.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya.. Tahun 1923, seorang ahli dari Denmark bernama Johanes N. Bronsted dan Thomas M. Lowry dari Inggris mengajukan konsep tentang asam basa secara terpisah, tapi dalam waktu.

Asam Basa Kelas 11 Konsep Bronsted Lowry YouTube
Pembahasan. Johannes Bronsted dan Thomas Lowry secara terpisah mengusulkan bahwa yang berperan dalam memberikan sifat asarn dan basa suatu larutan adalah ion atau proton. Menurut teori Bronsted-Lowry, asam adalah spesi kimia (ion atau molekul) yang berperan sebagai proton donor (pemberi proton) kepada suatu spesi yang lain.