
PPT Perkembangan Model Atom PowerPoint Presentation, free download ID398871
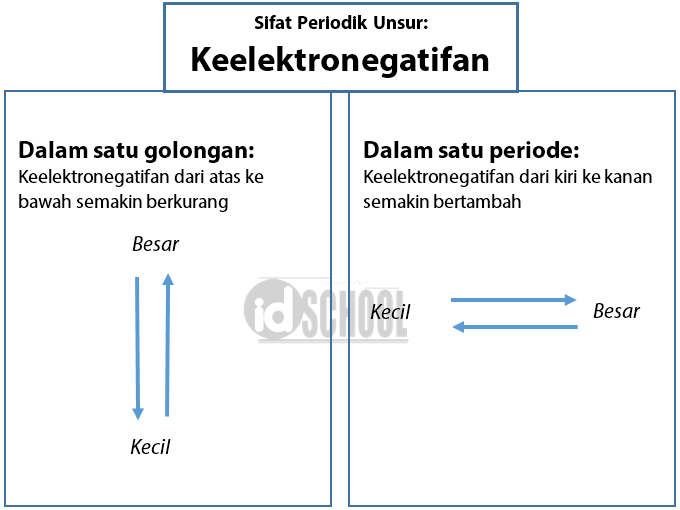
Keteraturan keelektronegatifan dalam sistem periodik: Dalam satu periode, keelektronegatifan semakin besar dari kiri ke kanan. Dalam satu golongan, keelektronegatifan semakin kecil dari atas ke bawah. Hal ini dikarenakan meski muatan inti bertambah positif, namun jumlah elektron di kulit dalam semakin banyak.

Keelektronegatifan Terbesar YouTube
konsep mudah menentukan kecendrungan grafik keelektronegatifan unsur-unsur yang diketahui nomor atomnya. kimia sma

Keelektronegatifan unsur dalam satu periodekimia sma YouTube
Keelektronegatifan ialah kecenderungan atom untuk menarik elektron kepada dirinya sendiri dalam ikatan kimia. Unsur yang paling elektronegatif ialah fluorin. Unsur paling elektronegatif atau paling elektropositif ialah fransium. Semakin besar perbezaan antara nilai keelektronegatifan atom, semakin polar ikatan kimia yang terbentuk di antara mereka.

Jari Jari Atom Unsur Dalam Satu Periode Dari Kiri Ke Kanan Semakin Kecil Karena Berbagai Unsur
Pengertian keelektronegatifan. Dilansir dari Chemistry LibreTexts, keelektronegatifan atau elektronegativitas adalah ukuran kecenderungan atom untuk menarik pasangan elektron. Makin besar keelektronegatifan suatu atom, maka makin kuat juga atom tersebut menarik elektron untuk kemudian berikatan secara kimia.

latihan soal UN keelektronegatifan dalam Satu golongan kimia SMA YouTube
Definisi Keelektronegatifan yaitu kecenderungan suatu unsur untuk menarik eleektron sehingga bermuatan negatif. Nah dalam sebuah Sistem Periodik Unsur terdafat sifat keperiodikan atau ciri khas perubahan nilai keelektronegatifan unsur, berikut ini adalah Sifat-Sifat Keperiodikan Unsur terhadap Keelektronegatifan.

Keelektronegatifan / Elektronegatifitas Suatu Unsur Adalah Sifat Yang Menyatakan tujuan dari
Yang mana, semakin negatif nilai afinitas elektron, berarti makin besar kecenderungan menyerap elektron. 4. Elektronegatifitas Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron ke dalam ikatannya ketika atomatom tersebut membentuk ikatan. Keelektronegatifan diukur dengan menggunakan skala Pauling yang besarnya antara 0,7.

PPT SIFATSIFAT PERIODIK UNSUR Jarijari atom Energi Ionisasi Afinitas elektron
Skala yang berbeda telah dikembangkan untuk mengukur keelektronegatifan. Meskipun prinsip di balik setiap skala berbeda dan nilai keelektronegatifan setiap elemen bervariasi menurut skalanya, mereka semua mengukur kecenderungan atau kemampuan yang sama untuk menarik elektron.

Apa itu Keelektronegatifan Kimia Atom YouTube
Dengan demikian grafik yang menunjukkan kecenderungan keelektronegatifan unsur-unsur di atas yang paling sesuai adalah grafik turun. Jadi, jawaban yang tepat adalah A. Berdasarkan data nomor atom unsur-unsur pada tabel di atas, dapat diketahui bahwa unsur K, L, M dan N merupakan unsur golongan VIIA (halogen)..

Trik Super Kilat Memahami Keelektronegatifan
Elektronegativitas. Elektronegativitas atau keelektronegatifan (Simbol: χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya sebuah gugus fungsi) untuk menarik elektron (atau rapatan elektron) menuju dirinya sendiri pada ikatan kovalen. [1] Konsep elektronegativitas pertama kali oleh Linus Pauling pada.

PPT IKATAN KIMIA PowerPoint Presentation, free download ID6053258
Pembahasan Keelektronegatifan merupakan kecenderungan atau ukuran kemampuan suatu unsur untuk menarik elektron dan dalam membentuk ikatan, semakin besar keelektronegatifan suatu atom maka akan memiliki kecenderungan lebih tinggi dalam menarik elektron daripada atom yang lain.Konsep keelektronegatifan ini pertama kali diajukan oleh Linus Pauling (1901-1994) pada tahun 1932.

Jelaskan Energi Ionisasi dan Keelektronegatifan? Fisika Kimia
Kecenderungan keelektronegatifan adalah sifat unsur dalam tabel periodik yang menunjukkan kemampuan atom dalam menarik elektron. Sifat ini sangat penting dalam membentuk ikatan kimia antara unsur-unsur yang berbeda. Semakin tinggi keelektronegatifan sebuah unsur, semakin besar pula kemampuan atom tersebut untuk menarik elektron. Dalam aplikasinya, kecenderungan keelektronegatifan sangat.

Sifat Keperiodikan Unsur ( Part 2) Afinitas Elektron, Keelektronegatifan dan Sifat Logam
Pada kali ini Kecenderungan Elektronegatifitas dalam Sistem Periodik menjadi topik bahasan dalam artikel berikut. Nilai Keelektronegatifan atau Elektronegatifitas memiliki pengaruh dalam sistem periodik untuk menggolongkan unsur-unsur di dalamnya. Berikut penjelasan tentang kecenderungan elektronegafitas tersebut semoga bermanfaat!
Sifat Periodik Unsur
Diketahui, keelektronegatifan senyawa atau unsur dalam satu golongan berbeda mengikuti kecenderungan tertentu. Baca juga: Apa yang Dimaksud dengan Keelektronegatifan? Dilansir dari Angelo State University, keelektronegatifan meningkat dari bawah ke atas dalam suatu golongan. Artinya, makin ke atas golongan maka makin tinggi keelektronegatifannya.

Diketahui keelektronegatifan unsur H, Cl, F dan Br secara berturutturut yaitu 2,1; 2,0; 4,0; 2
Keelektronegatifan adalah nilai kecenderungan suatu atom untuk menarik elektron dalam pembentukan ikatan kimia. Perhatikanlah Gambar berikut. Sifat keperiodikan keelektronegatifan: Dalam satu golongan, keelektronegatifan meningkat dari bawah ke atas. Adapun dalam satu periode, keelektronegatifan meningkat dari kiri ke kanan.

PPT PERKEMBANGAN SISTEM PERIODIK UNSUR PowerPoint Presentation ID903267
Keelektronegatifan adalah kecenderungan atom untuk menarik elektron ke dirinya sendiri dalam ikatan kimia. Unsur yang paling elektronegatif adalah fluor. Unsur yang paling tidak elektronegatif atau paling elektropositif adalah fransium. Semakin besar perbedaan antara nilai elektronegativitas atom, semakin polar ikatan kimia yang terbentuk di.
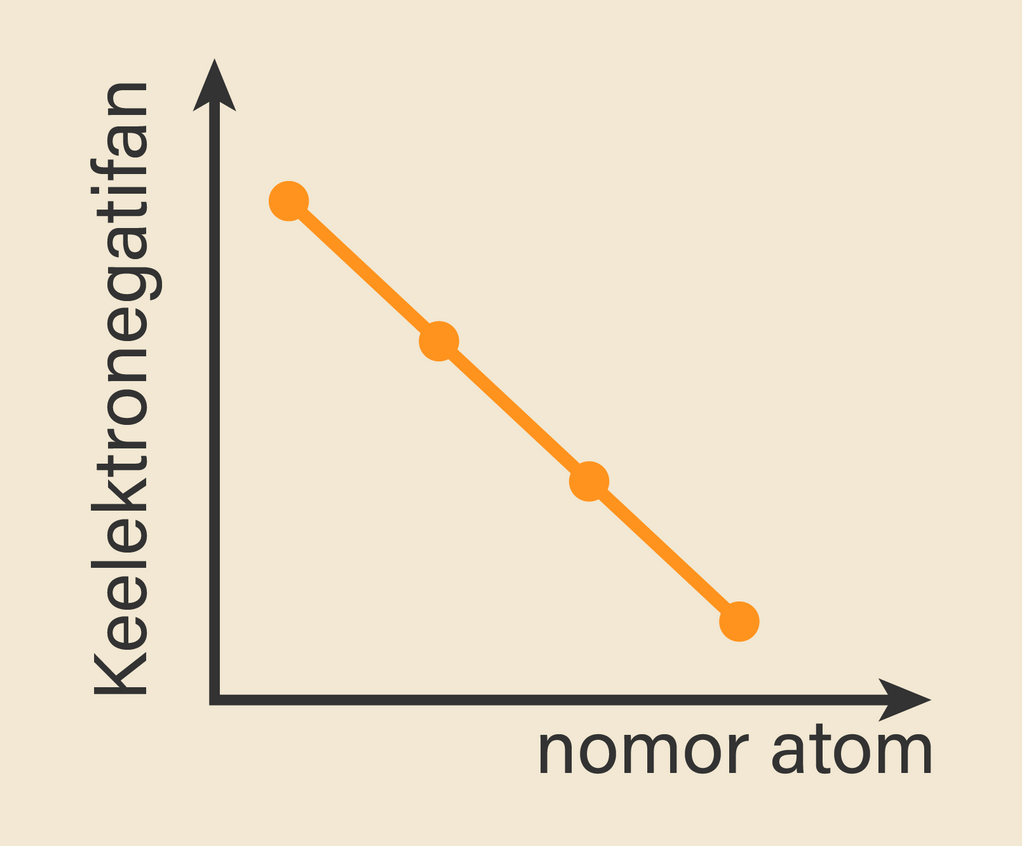
Berikut tabel data unsur dan nomor atomnya.
Secara sederhana, keelektronegatifan dapat diartikan sebagai suatu bilangan yang menggambarkan kecenderungan suatu unsur untuk menarik elektron ke pihaknya dalam suatu ikatan kimia. Jadi, keelektronegatifan tidak dikaitkan dengan pembentukan ion seperti halnya energi ionisasi dan afinitas elektron.