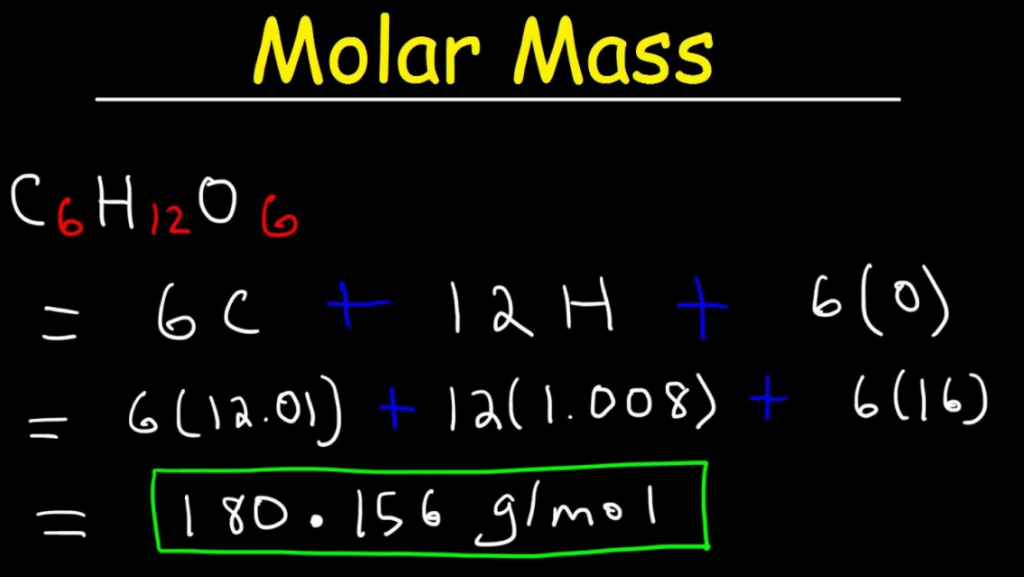
What is Molar Mass? Definition, Formula & Examples
Satuan molalitas. Molalitas adalah besaran turunan yang memiliki satuan. Dilansir dari ChemistryGod, satuan standar molalitas adalah mol per kilogram (mol/kg) atau kerap disebut sebagai molal. Molal biasanya dilambangkan dengan huruf "m". Misalnya, molalitas suatu larutan adalah 12 mol/kg, maka dapat dinyatakan sebagai 12 molal atau 12 m.

Molalitas atau molal YouTube
PARTIAL MOLAL/MOLAR VOLUME KELOMPOK XV/KAMIS SIANG. Dheas Pinda Prayoga 5008211026 I. G. Putu Farrell Aditya 5008211116. ASISTEN. Mayongga Heriz Febrada NRP: 02211940000182.. maka volumenya bertambah 18 cm3 dan kita dapat mengatakan bahwa 18 cm3 mol-1 adalah volume molar air murni. Walaupun mengatakan demikian, jika kita menambahkan 1 mol.

Diketahui Titik Didih Larutan Urea Molal Adalah C My XXX Hot Girl
Kenaikan titik didih adalah salah satu dari empat sifat koligatif larutan, yaitu sifat larutan yang dipengaruhi oleh partikel zat pelarut.. Dilansir dari Chemistry Libretexts, konstanta kenaikan titik didih sama dengan perubahan titik didih untuk larutan satu molal dari zat terlarut molekuler yang tidak mudah menguap. Jika pelarut murni yang.

Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Molalitas adalah jumlah mol zat terlarut per kilogram pelarut. Yang penting adalah massa pelarut yang digunakan dan bukan massa larutan. Larutan berlabel konsentrasi molal dilambangkan dengan huruf kecil m. Larutan 1,0 m mengandung 1 mol zat terlarut per kilogram pelarut.

Massa Molar Materi Stoikiometri Kimia SMA Pojan.id YouTube
Jika molalitas adalah Kemolalan atau konsentrasi molal (m) menyatakan banyaknya mol zat terlarut dalam 1000 gram pelarut sedangkan molaritas adalah pernyataan jumlah mol zat terlarut dalam setiap satu liter larutan. Molaritas dilambangkan dengan notasi M dan satuannya adalah mol/liter. (Baca Juga : Perbedaan Larutan Elektrolit dan Non Elektrolit )

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
Baik m dan M adalah satuan konsentrasi larutan kimia. Huruf kecil m menunjukkan molalitas, yang dihitung menggunakan mol zat terlarut per kilogram pelarut . Suatu larutan yang menggunakan satuan-satuan ini disebut larutan molal (misalnya, 0,1 m NaOH adalah larutan 0,1 molal natrium hidroksida).

Moles, Molarity and Concentration Edexcel 91 Separate (Triple) Science by chemistryteacher001
Adapun, satuan standar molalitas adalah mol per kilogram (mol/kg) atau sering kali disebut sebagai molal. Lambang dari molal adalah huruf "m". Sebagai contoh suatu larutan adalah 13 mol/kg maka dapat dinyatakan sebagai 12 molal atau 12 m. Molalitas merupakan jumlah mol zat terlarut dalam 1.000 gram pelarut. Maka, berikut rumus molalitas.

PPT Stoikiometri PowerPoint Presentation, free download ID6459484
This provides a means for finding the partial molal volumes, as shown in Figure 1.14.1.One measures the molar volume of the solution at a set of x 2 values. At a particular value x 2 =b, a tangent to the curve is drawn.The points of intersection of this tangent at x 2 =0 and 1 yield the desired quantities V ¯ 1 and V ¯ 2, respectively.Other methods for finding partial molal volumes are cited.

PPT Molarity and Molality PowerPoint Presentation, free download ID2012329
Massa molar. Massa molar, simbol M, [1] adalah massa dari satu mol sebuah unsur atau senyawa kimia. [2] Ia merupakan sifat fisik dari tiap-tiap senywa murni. Satuan SI untuk massa adalah kilogram, [1] namun atas alasan praktis dan historis, massa molar hampir selalu dituliskan dalam satuan gram per mol (g/mol), utamanya dalam bidang kimia.
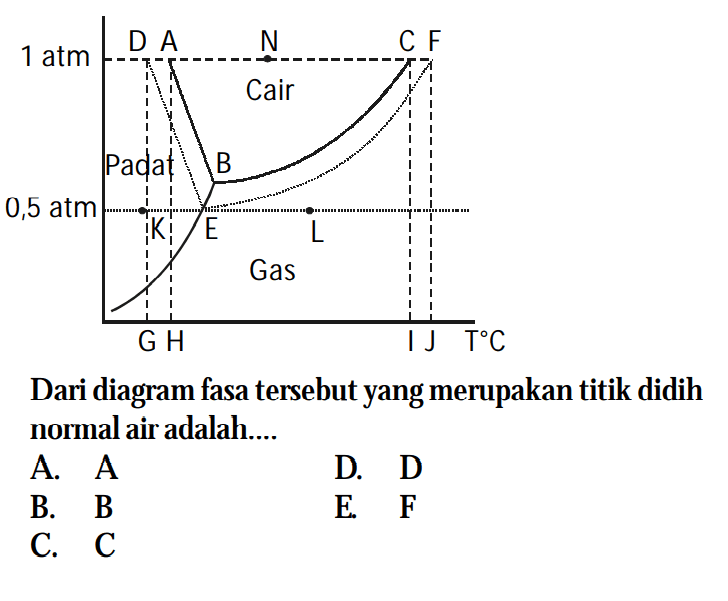
Diketahui titik didih larutan urea 0,4 molal adalah 100,2...
Molalitas, disebut pula sebagai konsentrasi molal, adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam sejumlah massa tertentu dari pelarut.Hal ini berbeda dengan definisi molaritas yang berdasarkan pada volume tertentu larutan.. Satuan yang umum digunakan untuk molalitas dalam kimia adalah mol/kg.Suatu larutan dengan konsentrasi 1 mol/kg juga.

Materi Kimia Molaritas Guru Paud
m = molalitas suatu zat (molal) p = massa pelarut (gr) n = mol suatu zat (mol) Normalitas Larutan (N) Normalitas yaitu besaran yang menyatakan jumlah mol ekivalen zat terlarut pada tiap satuan volume larutan. Satuan normalitas ialah normal (N) yang sama dengan mol ekivalen/liter. Rumus normalitas larutan adalah. N = ek/V atau N = n x a /V atau.
[Solved] Temperature dependence of molarity and molality 9to5Science
Soal dan Jawaban Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas. 1. Konversi molal ke % massa. Contoh soal: Hitunglah % massa dari larutan NaI 0,2 molal (massa molar NaI = 150 g/mol) Penyelesaian: Arti 0,2 molal NaI adalah 0,2 mol NaI dalam 1 Kg pelarut air. massa NaI sebanyak 0,2 mol = 0,2 mol x 150 g/mol = 30 g.

PPT Konsep Mol dan Stoikiometri PowerPoint Presentation, free download ID1812323
Contoh soal molalitas suatu larutan 20% berat C2H5OH (Mr = 46 g/mol) adalah.. Cara mengerjakan molalitas: C2H5OH 20% artinya 20 gram. C2H5OH dalam 80 gram air. m = massa x 1.000 = 20 x 1.000 = 5,4. Mr P 46 80. Jadi, kemolalan larutan 20% berat C2H5OH adalah 5,4 m. Selamat belajar contoh soal molalitas, detikers!
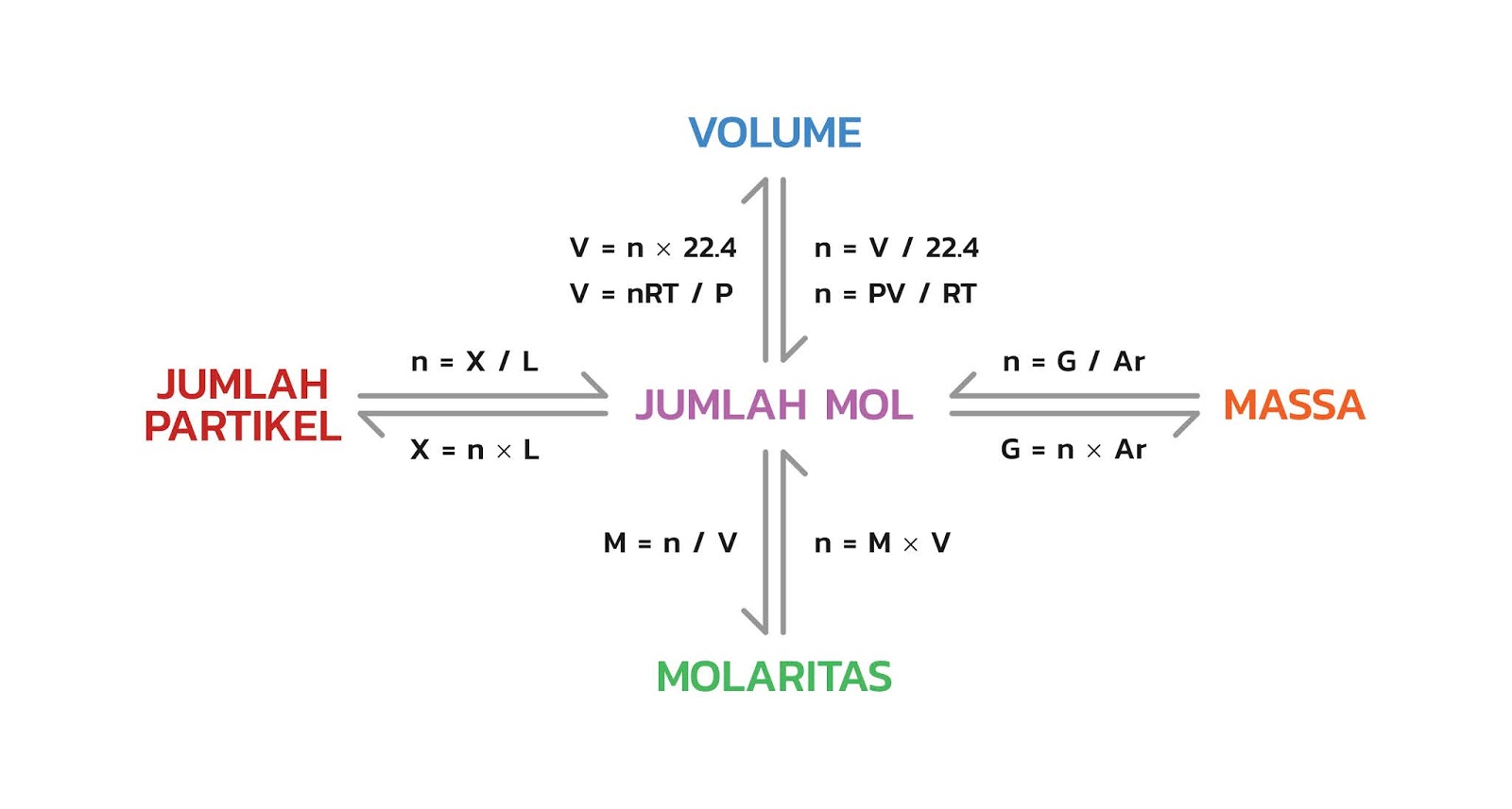
Selanjutnya kita coba bahas satusatu untuk setiap komponen.
Dalam beberapa kasus, penggunaan berat adalah keuntungan karena massa tidak berbeda dengan kondisi lingkungan. Adalah penting massa pelarut digunakan dan bukan massa larutan. Larutan yang ditandai dengan konsentrasi molal ditandai dengan huruf kecil m. Larutan 1,0 m berisi 1 mol zat terlarut per kilogram pelarut.

Menghitung Jumlah mol jika diketahui Massa Molar Zat dan Massa Molekul Relatif YouTube
Jadi, molaritas dari larutan urea adalah 0,2 Molar atau 0,2 mol/liter. Itu dia penjelasan mengenai rumus molaritas dan molalitas suatu larutan dalam Kimia. Masih sering merasa kesulitan belajar materi dari sekolah. Langganan paket belajar Zenius aja yuk, lewat penjelasan dari tutor yang asyik dan ilustrasi yang menarik bikin belajar nggak.

Contoh Soal Molaritas Dan Pembahasannya
= 0,52 °C molal-1 x 0,2 molal = 0,104 °C Jadi, kenaikan titik didih larutan gula tersebut adalah 0,104°C. Contoh Soal 2 Kenaikan Titik Didih. Suatu zat nonelektrolit yang massanya 3,42 gram dilarutkan dalam 200 gram air. Larutan itu mendidih pada suhu 100,026°C. Tentukan massa molekul zat tersebut jika K b air = 0,52 °C molal-1. Pembahasan