
SIFAT KOLIGATIF LARUTAN PENURUNAN TITIK BEKU YouTube
Pembahasan. Penurunan titik beku adalah fenomena perubahan titik beku menjadi lebih kecil ketika adanya zat terlarut di dalam pelarut. Hubungan penurunan titik beku dengan konsentrasi larutan pun berbanding lurus. Maksudnya ialah, apabila suatu zat memiliki konsentrasi semakin tinggi, maka panas yang dibutuhkan untuk membekukan suatu larutan.

Sifat Koligatif Larutan Penurunan Titik Beku Sains Kimia
Persamaan Penurunan Titik beku. Penurunan titik beku dapat dihitung menggunakan persamaan Clausius-Clapeyron dan hukum Raoult. Dalam larutan ideal encer titik beku adalah: Titik beku larutan total = Titik beku larutan - ΔTf. dimana ΔTf = molalitas * Kf * i. K f = konstanta titik beku air (1,86 ° C kg / mol ) i = Faktor Van't Hoff.

Penurunan Titik Beku Catatan Pak Rizal
ΔTf: penurunan titik beku m: molalitas larutan Kf: konstanta penurunan titik beku (°C kg/mol) Contoh aplikasi penurunan titik beku. Contoh aplikasi penurunan titik beku adalah dengan menaburkan garam di jalanan musim dingin. Pada musim dingin, uap air dan air mudah membeku membentuk lapisan es, sehingga jalanan sulit untuk dilewati.

Menentukan Rumus Molekul Senyawa dari Penurunan Titik Beku YouTube
Setelah didapatkan data titik beku naftalena dalam asam asetat maka dapat dihitung harga ∆Tf (penurunan titik beku). Penurunan titik beku larutan adalah selisih antara titik beku pelarut murni dengan larutan. Selain itu, dengan menggunakan cara yang sama, dapat dihitung pula penurunan titik beku dari zat X. Perbedaan titik beku naftalena.

Diketahui data percobaan penurunan titik beku bebe...
Dalam persamaan di atas, T F adalah titik beku normal dari pelarut murni (273 K untuk air, contohnya); a liq adalah aktivitas pelarut dalam larutan (aktivitas air untuk larutan berair); ΔH fus T F adalah perubahan entalpi fusi dari pelarut murni pada T F, yaitu 333.6 J/g untuk air pada 273 K; ΔC fus p adalah perbedaan antara kapasitas panas.

Larutan yang memiliki titik beku paling rendah adalah.
Penurunan titik beku adalah penurunan titik beku pelarut akibat penambahan zat terlarut yang tidak mudah menguap. Penurunan titik beku dalam kehidupan sehari-hari yaitu :. Hewan-hewan yang tinggal di daerah beriklim dingin, seperti beruang kutub yang memanfaatkan sifat koligatif larutan, yaitu penurunan titik beku untuk bertahan hidup.

Praktikum Penurunan Titik Beku Pada Pembuatan Es Krim II Sifat Koligatif Larutan YouTube
Titik beku larutan = 0 °C - 18,6 °C = -18,6 °C. 2. Diketahui Mr Urea (CO (NH2)2) = 60 g/mol, Kf air = 1,86 0 C/m, dan tekanan uap pelarut air pada suhu 25 0 C sebesar 23,75 mmHg, dan tekanan uap larutan urea pada 25 0 C sebesar 22,56 mmHg. Titik beku larutan urea tersebut adalah…. xp = P = 22,56 mmHg = 0,95.
Penurunan Titik Beku Larutan (ΔTf) SERBA SERBI
Titik beku. Titik beku adalah suatu kondisi suhu saat zat cair berubah wujud menjadi padat. Adapun titik beku besarnya sama dengan titik lebur yakni 0°C. Titik lebur. Titik lebur atau titik leleh adalah suatu kondisi suhu saat benda padat meleleh menjadi cair. Sementara itu, titik lebur suatu zat dipengaruhi oleh: Tekanan

Data percobaan penurunan titik beku Larutan Konsentrasi
Rumus Perhitungan Penurunan Titik Beku. Penurunan titik beku (ΔTb) pada suatu larutan dapat dihitung menggunakan Rumus Colligative Properties, yang terkait dengan penambahan zat terlarut. Rumus ini didasarkan pada hukum Raoult dan dapat dinyatakan sebagai: ΔTb=i⋅Kb⋅mΔTb=i⋅Kb⋅m. Di mana: ΔTb adalah penurunan titik beku,

Data percobaan penurunan titik beku Larutan Konsentra...
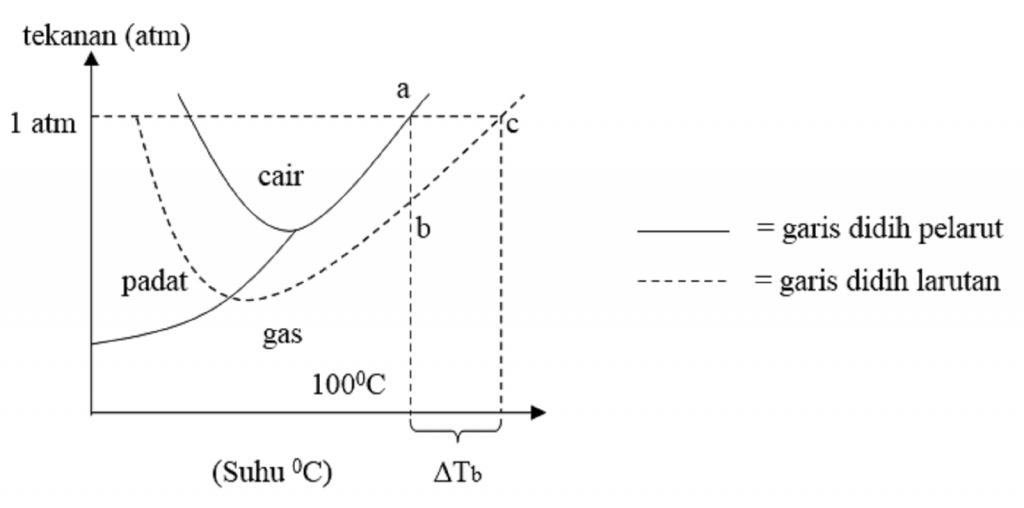
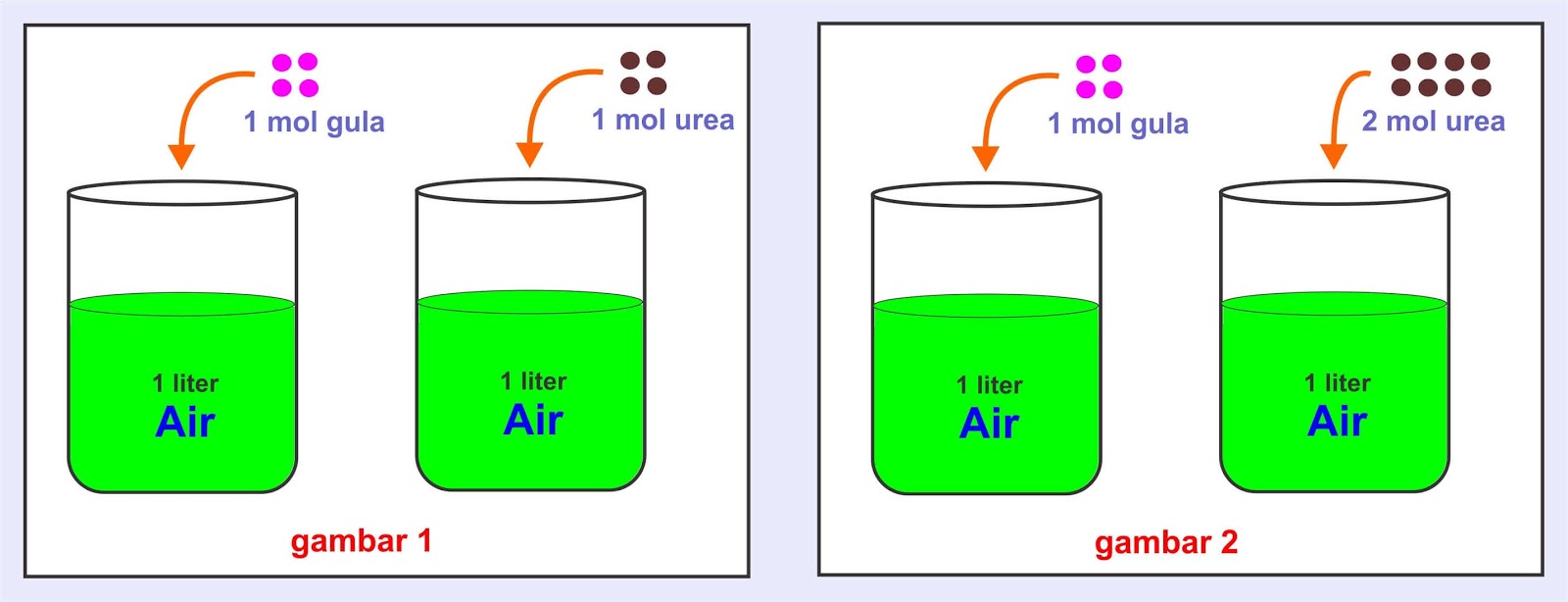
Sifat koligatif larutan berupa penurunan titik beku, ΔT f, yaitu T f ° - T f berbanding lurus terhadap konsentrasi (molalitas, m) larutan, sebagaimana: di mana K f adalah konstanta penurunan titik beku molal (dalam satuan °C/m) dan m adalah molalitas larutan. Tekanan Osmosis;

Perhatikan diagram PT air, larutan urea 0,1 m dan NaC...
Pengertian dan Rumus Penurunan Titik Beku Menurut Rananda Vinsiah dalam Fenomena Sifat Koligatif Larutan Kimia Kelas XII (2020, hlm. 19), titik beku merupakan kondisi ketika tekanan uap suatu cairan sama dengan tekanan padatannya. Pada kondisi seperti itu, cairan akan mulai membeku. Seandainya ada suatu zat terlarut yang dicampurkan ke pelarut murni, akan tercipta larutan baru.
Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Salah satu sifat penting dari suatu larutan adalah penurunan titik beku. Titik beku adalah temperatur tetap dimana suatu zat tepat mengalami perubahan wujud dari cair ke padat. Setiap zat yang mengalami pembekuan memiliki tekanan 1 atm. Keberadaan partikel-partikel zat pelarut mengalami proses pengaturan molekul-molekul dalam pembentukan.
Modul I Sifat Koligatif Larutan Penurunan Titik Beku Larutan Mobile
Nah, berdasarkan penjalasan tadi, dapat dinyatakan bahwa penurunan titik beku larutan adalah selisih antara titik beku pelarut dengan titik beku larutan. Besarnya penurunan titik beku larutan diberi lambang ∆T f. Harga ∆T f ditentukan oleh banyaknya partikel zat terlarut dan tidak ditentukan oleh sifat zat terlarutnya.

Apa yang dimaksud dengan penurunan titik beku 2021
Berikut rumus penurunan titik beku. Titik beku bisa diartikan sebagai suhu saat zat cair berubah menjadi padat. Berikut rumus penurunan titik beku.. 1,86 ° C Tfl = - 1,86 ° C Jadi, titik beku larutan adalah - 1,86 ° C. Soal 2. Tentukan titik beku larutan 0,025 mol suatu senyawa dalam 250 gram air, jika Kf air = 1,86º C/m! Jawaban: m.

1 .Sifat Koligatif Larutan _ c. Kenaikkan Titik Didih dan Penurunan Titik Beku Larutan YouTube
Salah satu sifat penting dari suatu larutan adalah penurunan titik beku. Titik beku adalah temperatur tetap dimana suatu zat tepat mengalami perubahan wujud dari cair ke padat. Setiap zat yang mengalami pembekuan memiliki tekanan 1 atm. Keberadaan partikel-partikel zat pelarut mengalami proses pengaturan molekul-molekul dalam pembentukan.

Rumus titik beku larutan
Selisih antara titik beku pelarut dengan titik beku larutan disebut penurunan titik beku. Rumus penurunan titik beku Penurunan titik beku berbanding lurus dengan. Larutan urea adalah larutan non elektrolit sedangkan larutan NaCl adalah larutan elektrolit. Penurunan titik beku Urea: ΔTf = Kf . gr. Mr. x . 1000. p. 0 - (-0,367) = Kf . 11,7.