Pada termodinamika gas ideal mengalami proses isotermik jika Black Liff
Sedangkan, jika volume diturunkan (dikompresi), maka suhu sistem akan naik. Adapun, sistem termodinamika dapat memiliki lebih dari satu jenis proses termodinamika. Misalnya, suatu sistem dapat mempertahankan suhu dan jumlah kalor di dalamnya dengan menjalankan proses isotermal dan adiabatik.

TERMODINAMIKA DASAR LENGKAP ISOKHORIK, ISOBARIK, ISOTERMIK, ADIABATIK YouTube
Hukum ini dapat diuraikan menjadi beberapa proses, yaitu proses dengan Isokhorik, Isotermik, Isobarik, dan juga adiabatik. Hukum kedua Termodinamika. Hukum kedua termodinamika terkait dengan entropi. Tidak ada bunyi untuk hukum kedua termodinamika yang ada hanyalah pernyataan kenyataan eksperimental yang dikeluarkan oleh kelvin-plank dan clausius.

Sejumlah Gas Ideal Mengalami Proses Isokhorik Sehingga
a. Proses isotermik Jika pada suatu sistem, proses yang terjadi berlangsung dalam suhu konstan (ΔT = 0), maka proses ini dinamakan proses isotermik. Karena berlangsung dalam suhu konstan, tidak terjadi perubahan energi dalam (ΔU = 0) dan berdasarkan Hukum I Termodinamika kalor yang diberikan sama dengan usaha yang dilakukan sistem (Q = W).

Jelaskan Proses Isotermik Isobarik Isokhorik Adiabatik
Kita akan membahas pro ses-proses termodinamik yang sering terjadi pada keadaan praktis. Proses-proses ini dapat diringkas sebagai 'tanpa perpindahan panas' atau adiabatic, 'volume kontan' atau isokhorik, 'tekanan konstan' atau isobaric dan 'suhu konstan' atau isotermal.Untuk beberapa diantaranya kita menggunakan hukum Pertama termodinamika yang disederhanakan.

Hukum Boyle (isotermik) Kelas VIII YouTube
Hukum ini bisa diuraikan menjadi beberapa proses yaitu proses dengan isokhorik, isotermik, isobarik dan adiabatik. 3. Hukum Termodinamika 2. Hukum termodinamika kedua ini terkait dengan entropi. Gak ada bunyi buat hukum kedua termodinamika, cuma ada pernyataan eksperimental yang dikeluarkan oleh kelvin-plank dan clausius.

Hukumhukum dan Proses pada Termodinamika
Sonora.ID - Berikut ulasan selengkapnya mengenai " Proses Termodinamika: Isotermal, Isobarik, Isokhorik, dan Adiabatik ". Termodianamika adalah sebuah hal yang bisa diamati pada suatu system. Sistem Termodinamika umumnya tidak selalu dalam keseimbangan ekuilibirium, melainkan dalam mengalami suatu proses termodinamika.

Pada Termodinamika Gas Ideal Mengalami Proses Isotermik Jika
Hukum ini diuraikan menjadi 4 proses termodinamika, yaitu . Isobarik (Tekanan tetap atau konstan) Isokhorik (Volume tetap atau konstan) Isotermik (Suhu tetap atau konstan) Adiabatik (sistem diisolasi agar tidak ada kalor yang keluar maupun masuk atau tidak terjadi pertukaran kalor) Hukum Termodinamika II (Arah Reaksi Sistem)

Fisika 11 Termodinamika 5 Proses Isotermik YouTube
Contoh proses isobarik dalam kehidupan sehari-hari adalah pemanasan air di dalam mesin uap. 2. Proses Isotermik. Proses termodinamika yang berlangsung tanpa perubahan suhu disebut dengan proses isotermik. Proses isotermik bisa diartikan sebagai transformasi atau perubahan keadaan sistem pada suhu yang konstan atau tetap. Nah, dalam proses.

TERMODINAMIKA PROSES ISOTERMIK YouTube
Proses isotermal, yaitu proses termodinamika di mana suhu suatu sistem tetap konstan. Perpindahan panas ke dalam atau ke luar sistem terjadi sangat lambat sehingga kesetimbangan termal dipertahankan. "Termal" adalah istilah yang menggambarkan panas suatu sistem. "Iso" berarti "sama", jadi "isotermal" berarti "sama panas", yang mendefinisikan.

Pada termodinamika gas ideal mengalami proses isotermik jika Black Liff
Verifying that you are not a robot.

Sejumlah Gas Ideal Menjalani Proses Isotermik Sehingga Seputar Jalan
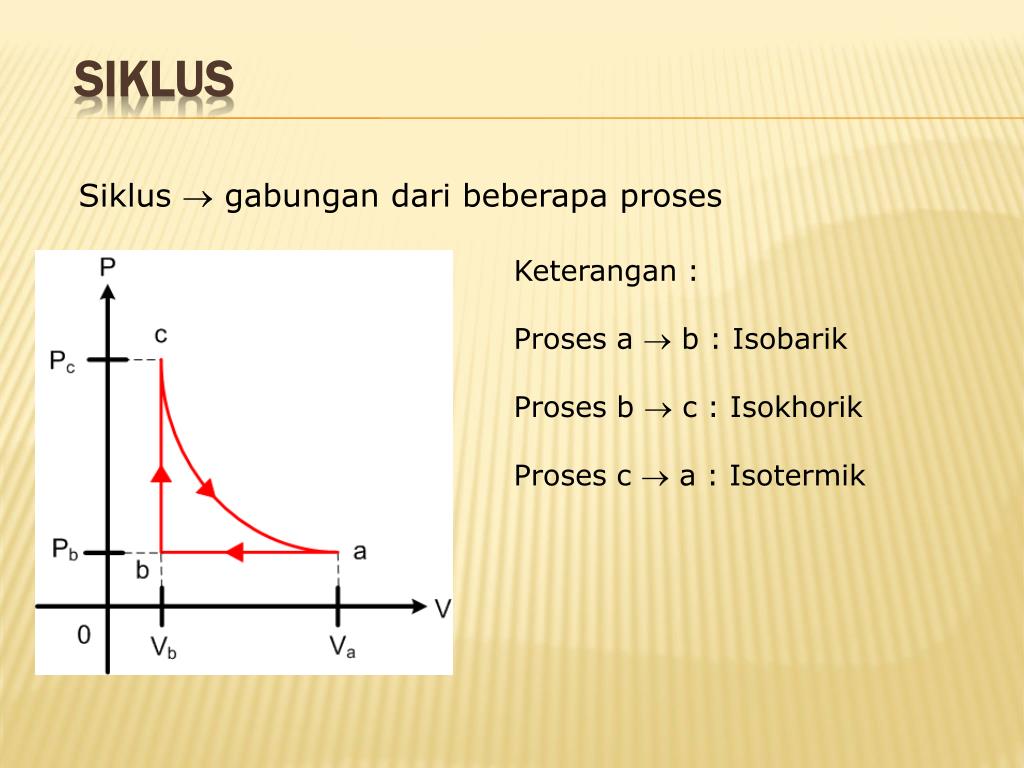
Pembahasan. Proses isotermal adalah proses perubahan keadaan suatu gas dalam ruang tertutup dapat dilakukan pada suhu tetap. Proses isokhorik adalah proses yang terjadi pada gas yang berada dalam ruang tertutup pada volume tetap. Proses isobarik merupakan proses pengubahan keadaan gas yang dilakukan pada tekanan tetap.

PPT TERMODINAMIKA PowerPoint Presentation, free download ID5975821
Proses isotermal adalah proses termodinamika di mana sistem mengalami perubahan termal dengan suhu konstan. Dalam proses ini, hukum termodinamika yang berkaitan adalah hukum pertama termodinamika dan hukum gas ideal. Proses isotermal memiliki berbagai penerapan dalam kehidupan sehari-hari, termasuk dalam kulkas, pembuatan es batu, dan pembuatan.

Soal dan Pembahasan Usaha Termodinamika pada Proses Isotermal dan Adiabatik YouTube
Isoterm adalah perubahan keadaan gas pada suhu yang tetap. Proses isotermal merupakan proses termodinamika yang prosesnya berjalan dan suhu gasnya tetap. Persamaan umum gasnya adalah P.V= n.R.T. Karena suhunya konstan, maka usaha yang dilakukan gas adalah: W= P.dV = n.R.T.dV/V.. Karena berlangsung dalam suhu yang kosntan, maka tidak terjadi perubahan energi dan berdasarkan hukum termodinamika.
Sejumlah Gas Ideal Menjalani Proses Isotermik Seputar Jalan
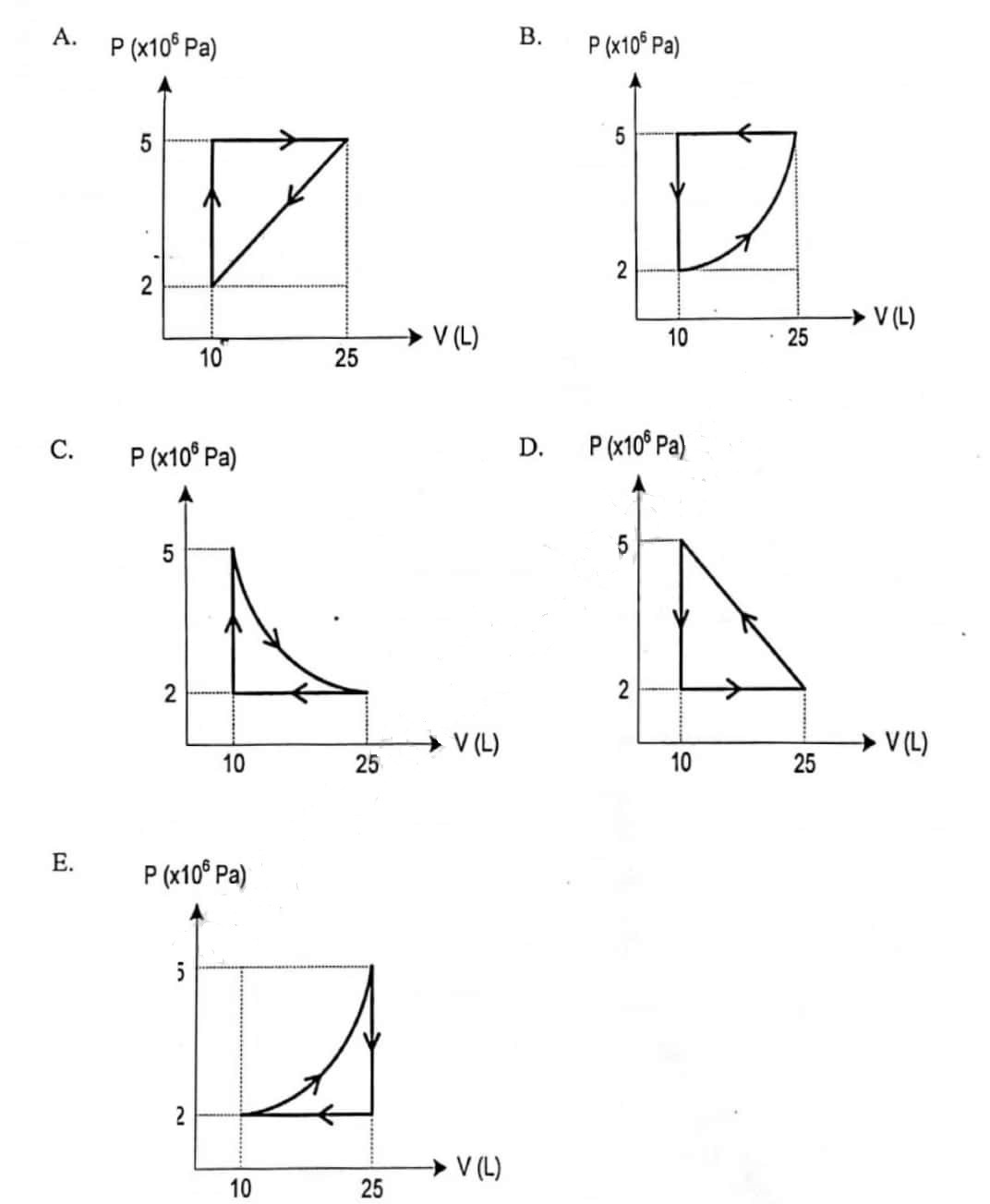
Untuk lebih jelasnya, perhatikan contoh soal dan pembahasannya dibawah ini. Contoh soal 1. Diagram P-V dari gas helium yang mengalami proses termodinamika ditunjukkan gambar dibawah ini. Diagram tekanan volume (P-V) Usaha yang dilakukan gas helium pada proses ABC sebesar…. A. 660 kj. B. 400 kj.

Isotermik ProsesProses dalam Termodinamika 5 YouTube
Dalam fisika ada termodinamika, yaitu cabang yang berfokus pada perubahan energi (kalor) dan sifat-sifat suatu sistem selama reaksi fisik atau kimia apa pun. Proses isotermal adalah proses termodinamika di mana suhu suatu sistem tetap konstan . Perpindahan panas masuk atau keluar dari sistem terjadi sangat lambat sehingga kesetimbangan termal.
PPT TERMODINAMIKA PowerPoint Presentation, free download ID5975821
Proses Isotermik. Proses isotermik adalah transformasi keadaan sistem pada suhu yang konstan atau tetap. Atau dalam kata lain, pada termodinamika, gas ideal mengalami proses isotermik jika perubahan keadaan gas suhunya selalu tetap. Dalam proses ini, persamaan pada transformasi energi dalam (ΔU = Q - W) adalah kegiatan yang linier dengan.