
14+ Contoh Soal Reaksi Ionisasi Asam Basa Contoh Soal Terbaru
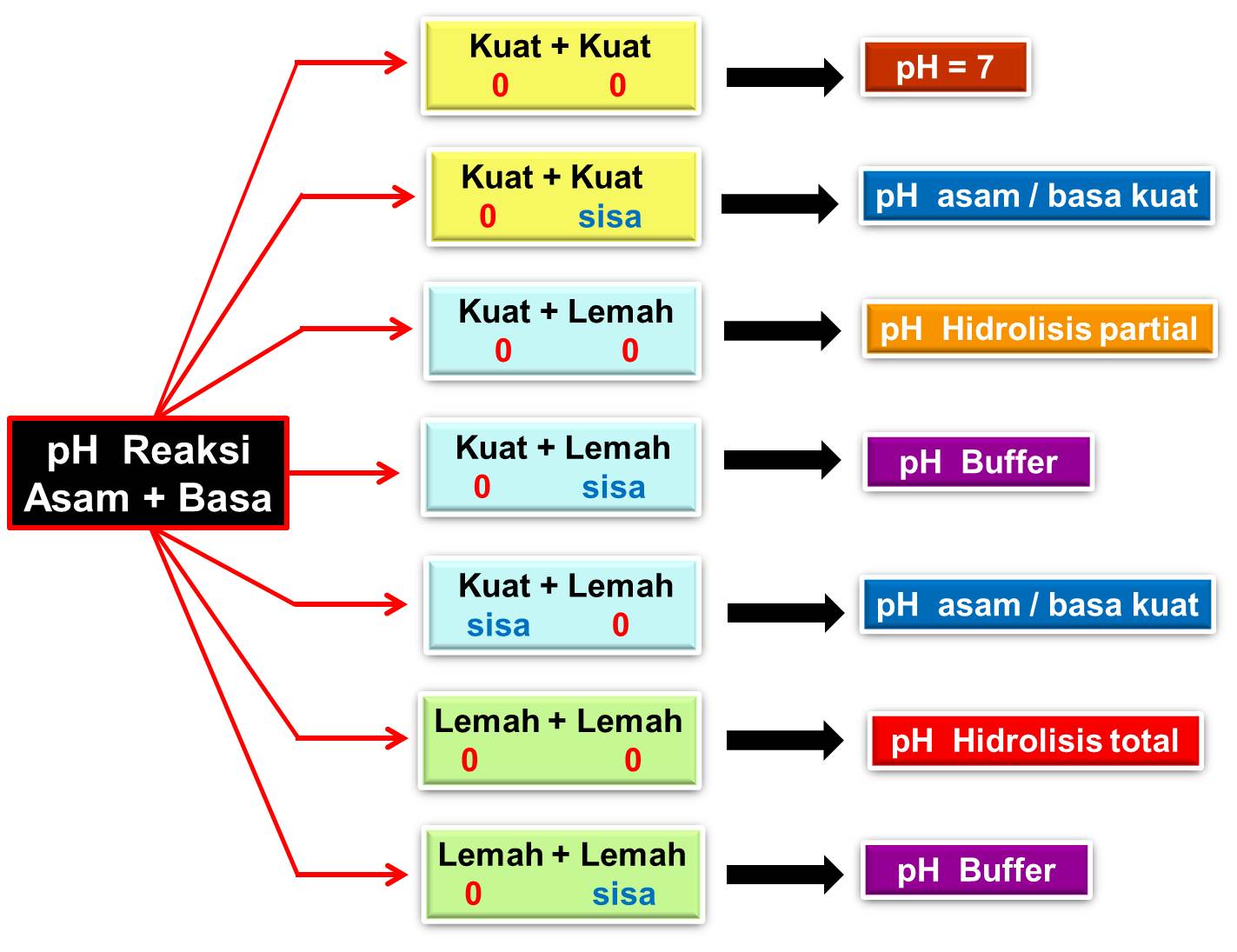
Artinya apabila reaksi asam kuat dicampurkan dengan basa kuat akan menghasilkan larutan dengan pH 7 atau netral. Asam basa lemah. Asam lemah adalah senyawa yang dilarutkan dalam air akan sulit melepaskan ion H+ dan mengalami disosiasi pada larutan. Sedangkan, basa lemah adalah senyawa yang apabila dilarutkan di dalam air akan sulit melepaskan.

Lengkapi persamaan reaksi ionisasi asam basa berikut!a.
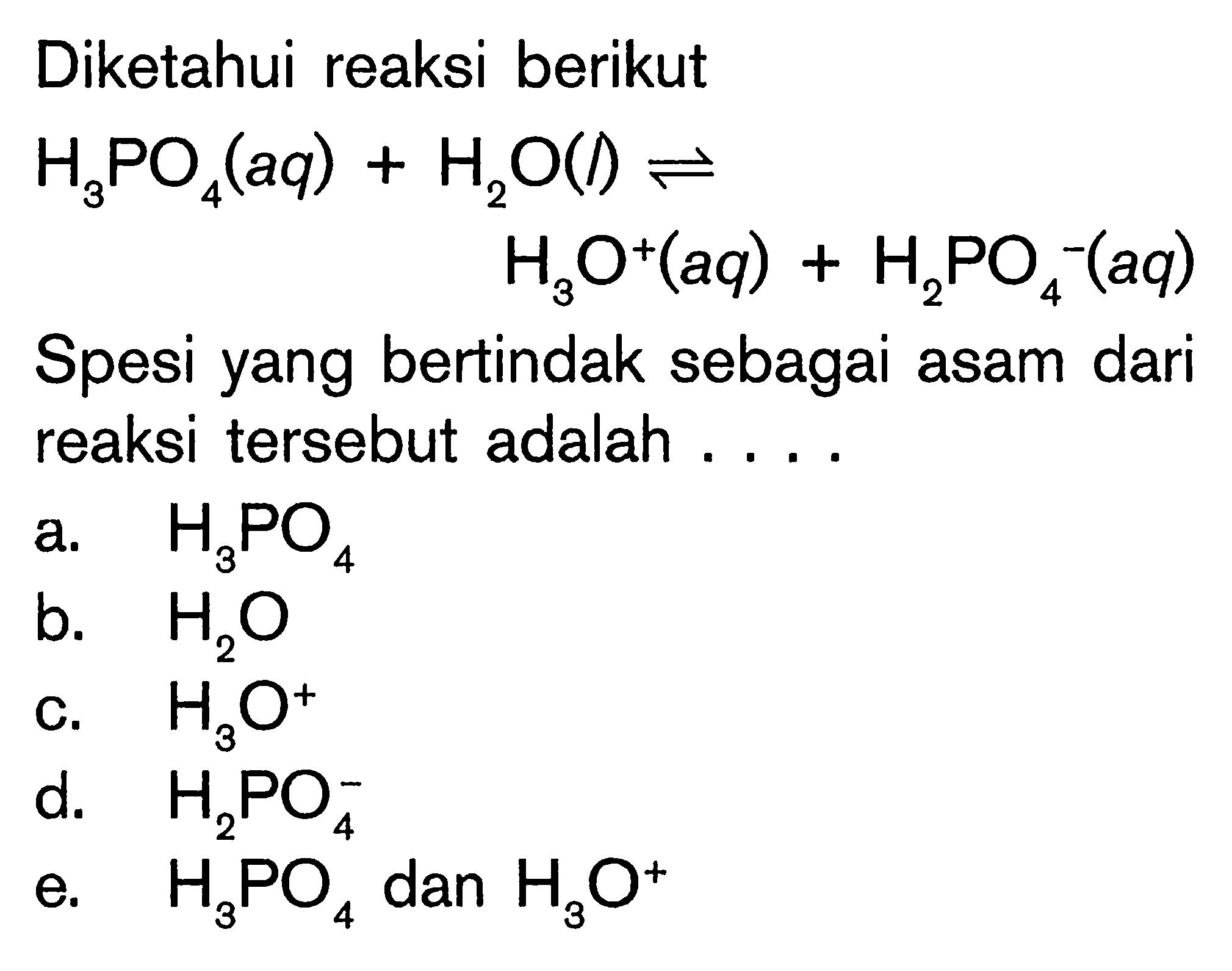
Pada tahun 1923, Johannes N. Brønsted dan Thomas M. Lowry secara terpisah mengajukan definisi asam dan basa yang lebih luas. Konsep yang diajukan tersebut didasarkan pada fakta bahwa reaksi asam-basa melibatkan transfer proton (ion H +) dari satu zat ke zat lainnya.Proses transfer proton ini selalu melibatkan asam sebagai pemberi/donor proton dan basa sebagai penerima/akseptor proton.
Sebutkan pasangan asambasa konjugasi dari reaksi berikut...
Reaksi asam basa adalah reaksi kimia yang melibatkan pereaksi asam dan basa, yang dapat digunakan dalam menentukan pH. Dalam suatu reaksi asam-basa, asam dan basa membentuk basa konjugat dan asam konjugat: Konjugat terbentuk saat asam kehilangan proton hidrogen atau basa memperoleh proton hidrogen. Lihat gambar berikut:

14+ Contoh Soal Reaksi Ionisasi Asam Basa Contoh Soal Terbaru
Reaksi asam basa adalah reaksi kimia yang terjadi karena adanya pertukaran satu atau lebih ion H+ pada molekul yang bersifat asam dan molekul yang bersifat basa. Ini artinya, reaksi asam basa dapat berlangsung di antara molekul asam dan basa.

Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −. Gas asam klorida (HCl) yang sangat larut dalam air tergolong asam Arrhenius, sebagaimana HCl dapat terurai menjadi ion H + dan Cl − di dalam air.

Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
asam basa asam basa asam juga terionisasi HCl + H 2O à H 3O+ + Cl- asam basa aam basa Self-ionisasi dari air (reaksi ke kanan) terjadi hanya sedikit. Berbeda jauh dengan ionisasi dari HCl, asam kuat, yang berjalan secara sempurna.

Reaksi ionisasi asam berikut yang benar berdasarkan defin...
By Abdillah Posted on 27/01/2024. Reaksi Asam Basa - Pengertian Reaksi Asam Basa (Reaksi Penetralan) didalam Ilmu Kimia adalah suatu Reaksi Kimia yang melibatkan Reagen (Zat atau Senyawa Kimia) Asam dan Reagen Basa yang dapat menghasilkan Garam dan Air. Reagen Asam yang dipakai dapat berupa Asam Lemah ataupun Asam Kuat, begitu pula dengan.

Persamaan Reaksi Ionisasi Asam Basa YouTube
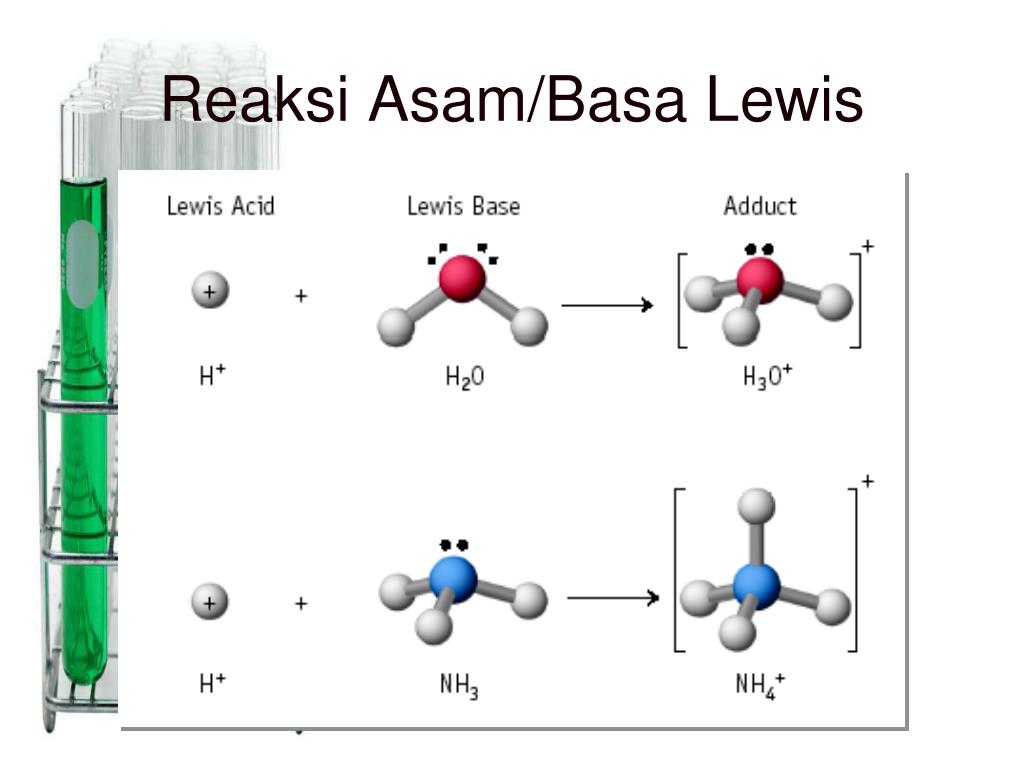
Pengertian Asam Basa Teori Asam Basa 1. Teori Asam Basa Brønsted-Lowry 2. Teori Asam Basa Arrhenius 3. Teori Asam Basa Lewis Sifat Asam Basa 1. Sifat Asam Rasa Asam yang Khas Bisa Mengubah Warna Indikator Bereaksi dengan Logam Tertentu Guna Menghasilkan Gas H2 Bereaksi dengan Basa Guna Membentuk Garam dan Air Bisa Menghantarkan Arus Listrik
PPT teori asam basa PowerPoint Presentation, free download ID78826
Reaksi Asam Basa. Reaksi ini terjadi ketika asam dan basa direaksikan, maka akan menghasilkan garam dan air (asam + basa → garam + H2O). Reaksi Pendesakan. Reaksi ini terjadi ketika suatu logam A bereaksi dengan larutan elektrolit BC, maka akan terjadi pendesakan.

Teori Asam Basa
Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl- Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20 H20 bersifat basa karena ia menerima donor H+
CINTA KIMIA PETA KONSEP pH REAKSI ASAM BASA
Dijelaskan dalam Jurnal UNY, teori Arrhenius menyimpulkan: 1. Asam: zat/senyawa yang dapat menghasilkan H+ dalam air. HCl (aq) à H+ (aq) + Cl - (aq) 2. Basa: zat/senyawa yang dapat menghasilkan OH- dalam air. NaOH (aq) à Na+ (aq) + OH - (aq) • Reaksi netralisasi adalah reaksi antara asam dengan basa yang menghasilkan garam:

Contoh Soal Reaksi Asam Basa Konjugasi Kumpulan Contoh Soal My XXX Hot Girl
Cara Membedakan Asam dan Basa. Senyawa asam dapat dengan mudah ditemukan pada buah-buahan, seperti jeruk dan lemon. Selain itu, bisa juga ditemukan pada bahan makanan, seperti cuka. Bahkan, senyawa asam juga banyak digunakan sebagai bahan pengawet makanan lho, misalnya asam benzoat yang dimanfaatkan sebagai pengawet jus buah dan selai.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
LENGKAP ‼️ CARA MENULISKAN REAKSI IONISASI ASAM, BASA, DAN GARAM 5NChemistry 6.95K subscribers Subscribe Subscribed 4K views 2 years ago Kimia kelas 10 Video ini berisi tentang bagaimana cara.

Reaksi Asam Basa Jegeristik
1. Asam Flourida (HF) Reaksi ionisasi: HF → H + + F - 2. Asam Sianida (HCN) Reaksi ionisasi: HCN → H + + CN - 3. Asam Asetat (CH 3 COOH) Reaksi ionisasi: CH 3 COOH → H + + CH 3 COO - Pelajari Juga: Contoh Katalis dalam Kehidupan Sehari-Hari 4. Asam Sulfida (H 2 S) Reaksi ionisasi: H 2 S → 2H + + S 2-

Tuliskan Reaksi Ionisasi Senyawa Natrium Hidroksida Dan Asam Fosfat Belajar di Rumah
Hidrolisis - Kimia Kelas 11 - Teori, Jenis Reaksi, dan Contoh Soal. by sereliciouz & Andjar Tyassih, S.Si. Agustus 28, 2019. Dalam artikel ini akan dibahas secara detail tentang teori dan reaksi hidrolisis, jenis-jenis reaksi hidrolisis, contoh soal dan pembahasan reaksi hidrolisis, dan aplikasi reaksi hidrolisis dalam kehidupan sehari-hari.

Reaksi Asam Basa Bagian 1 Materi Larutan Asam Basa Kimia SMA Pojan.id YouTube
PERSAMAAN REAKSI IONISASI ASAM BASA Tulis persamaan reaksi ionisasi asam atau basa berikuta. HNO3 (aq) →b. H2CO3 (aq) →c. CH3COOH (aq) →d. NH4OH (aq) →e. Ca.