
Kelompok Persamaan Reaksi Yang Mengalami Reduksi Ditunjukkan Oleh Nomor Terbaru
Reaksi oksidasi Fe oleh O 2: 4Fe + 3O 2. 2Fe 2 O 3 (Fe bertindak sebagai reduktor) Sumber: p0.pikist.com Konsep redoks berdasarkan pengikatan dan pelepasan elektron. Berdasarkan konsep ini, reduksi adalah reaksi terjadinya penerimaan elektron pada suatu spesi, sedangkan oksidasi adalah reaksi terjadinya pelepasan elektron pada suatu spesi. Contoh:

PPT KONSEP REAKSI REDUKSIOKSIDASI PowerPoint Presentation, free download ID5404853
Penghilangan warna oleh zat pemutih terjadi karena ada reaksi oksidasi. Oksidator yang biasa digunakan dalam zat pemutih adalah natrium hipoklorit (NaOCl) dan hidrogen peroksida (H2O2). Warna benda ditimbulkan oleh elektron yang diaktivasi oleh sinar tampak. Hilangnya warna benda disebabkan oksidator mampu menghilangkan elektron tersebut.

PPT Reaksi oksidasi reduksi PowerPoint Presentation, free download ID924292
Mulai dari Reaksi Reduksi, Reaksi Oksidasi, Fungsi Reaksi Redoks, Konsep Reaksi Redoks, Tata Nama Senyawa IUPAC, dan Contoh Soalnya. Baca selengkapnya di sini! ️. Aspek kunci dari reaksi ini adalah pelepasan dan penerimaan elektron oleh zat-zat kimia yang terlibat. Reaksi Oksidasi Berdasarkan Pelepasan Elektron.

Reaksi oksidasi senyawa senyawa organik
Kemudian konsep redoks berkembang dimana reaksi oksidasi merupakan reaksi yang melibatkan pelepasan elektron dan reaksi reduksi adalah reaksi yang melibatkan pengikatan elektron. Konsep tersebut ditunjukkan oleh persamaan reaksi kimia berikut. Na(s) + ½ Cl 2 (g) → NaCl (s) Reaksi di atas melibatkan dua peristiwa: Oksidasi : Na (s) → Na+ (s.

Oksidasi dan Reduksi Ilmu Kimia
Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
1 pt. Konsep reaksi oksidasi-reduksi berdasarkan penggabungan dan pelepasan oksigen menyatakan bahwa zat mengalami oksidasi apabila.. melepaskan oksigen. mengikat oksigen. memutuskan oksigen. bereaksi dengan oksigen. mengikat oksida. 12. Multiple Choice.

PPT Reaksi oksidasi reduksi PowerPoint Presentation, free download ID924292
Adapun karbon monoksida (3CO) mengalami reaksi oksidasi karena mengikat atom oksigen dan berubah menjadi karbon dioksida (3CO2).. Oleh karena itu, muncul konsep redoks yang ketiga, yaitu berdasarkan perubahan bilangan oksidasi (biloks). Bilangan oksidasi adalah muatan positif dan negatif pada suatu atom. Unsur yang biloksnya positif.

Reaksi oksidasi senyawa senyawa organik
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl ------> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0. Kemudian,

Mekanisme Reaksi Oksidasi Alkohol dengan Reaksi Oksidasi Swern YouTube
Pertanyaan. Diberikan lima persamaan reaksi oksidasi atau reduksi yang belum setara (1) MnO 4 - → MnO 4 2- (2) SO 2 SO 3 (3) C 2 H 4 C 2 H 6 (4) FeO Fe 2 O 3 (5) Cl 2 + 2e - 2Cl - Kelompok persamaan reaksi yang mengalami reduksi ditunjukkan oleh nomor.
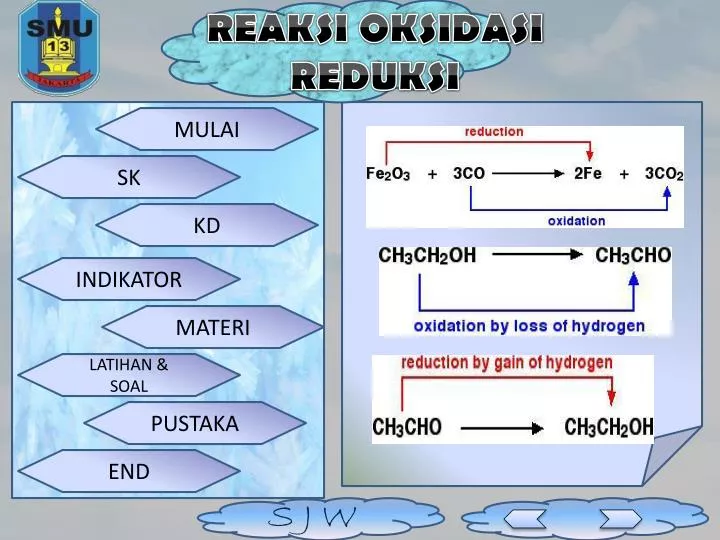
PPT REAKSI OKSIDASI REDUKSI PowerPoint Presentation, free download ID6935360
Diberikan lima persamaan reaksi oksidasi atau reduksi yang belum setara. MnO4 - → MnO4 2-. SO2 → SO3; C2H4 → C2H6; FeO → Fe2O3; Cl2 + 2e - → 2Cl - Kelompok persamaan reaksi yang mengalami reduksi ditunjukkan oleh nomor… A. 1, 2 dan 3 B. 1, 3, dan 4 C. 1, 3, dan 5 D. 2, 3, dan 4 E. 2, 3 dan 5. Pembahasan

Reaksi berikut yang merupakan reaksi oksidasi adalah....
Oksidasi adalah salah satu reaksi kimia yang perlu Anda pahami dan ketahui di dalam kimia. Dimana, oksidasi ini tentunya tidak bisa dipisahkan dengan reduksi. Keduanya membentuk reaksi reduksi-oksidasi atau biasa disebut redoks. Reaksi redoks sendiri adalah suatu reaksi pelepasan dan pengikatan oksigen. Redoks adalah istilah yang digunakan.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10
Redoks. Redoks adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia . Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH 4 ), ataupun ia dapat berupa proses yang.
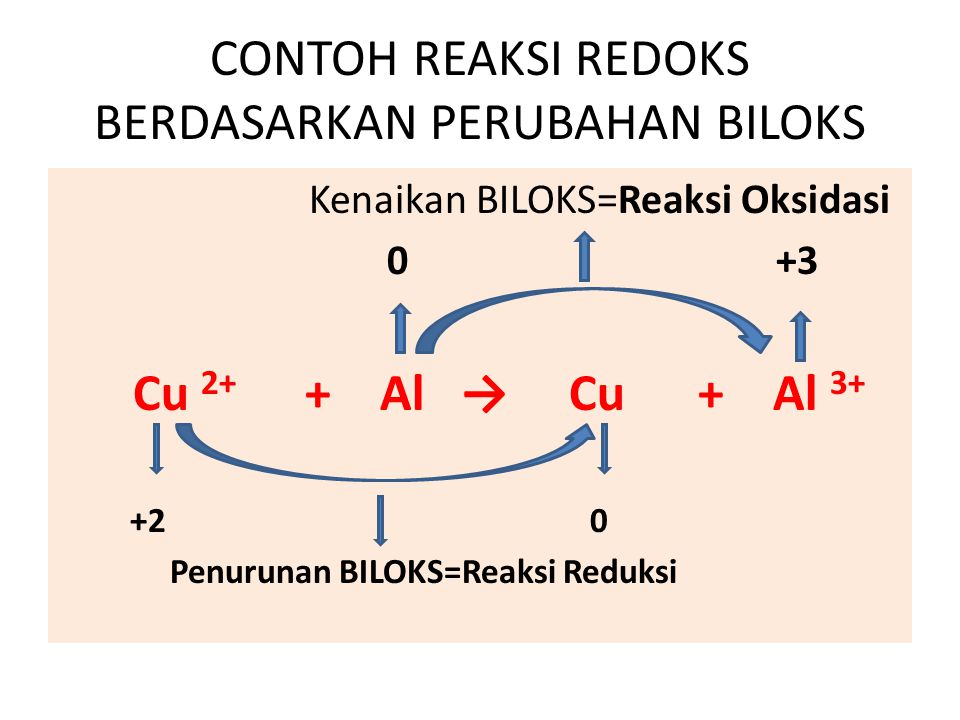
Cara Menyetarakan Reaksi Redoks dengan Metode Bilangan Oksidasi Materi Kimia
Pengertian Reaksi Redoks. Redoks adalah istilah yang menjelaskan perubahan bilangan oksidasi dalam sebuah reaksi kimia. Nah, lebih lanjut, hal ini dapat berupa reaksi redoks sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida (CO2), atau reduksi karbon oleh hidrogen sehingga menghasilkan metana (CH4), ataupun dapat berupa proses kompleks seperti oksidasi gula pada tubuh manusia.

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
3. mengalami reaksi oksidasi karena terjadi pengikatan oksigen. 4 . mengalami reaksi reduksikarena terjadi pelepasanoksigen. Reaksi yang mengalami reduksi ditunjukkan oleh nomor2 dan 4. Jadi, jawaban yang benar adalah D. Reaksi redoks terdiri dari reaksi reduksi dan reaksi oksidasi. Berdasarkan pelepasan dan pengikatan oksigen, reaksi reduksi.

Reaksi oksidasi soal kimia SMA YouTube
Pertanyaan. Diberikan lima persamaan reaksi oksidasi atau reduksi yang belum setara. ( 1 ) MnO 4 − → MnO 4 2 − ( 2 ) SO 2 → SO 3 ( 3 ) C 2 H 4 → C 2 H 6 ( 4 ) FeO → Fe 2 O 3 ( 5 ) Cl 2 + 2 e − → 2 Cl − Kelompok persamaan reaksi yang mengalamireduksi ditunjukkan oleh nomor.

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Oleh karena itu, oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, sedangkan reduksi sebagai penurunan bilangan oksidasi. Dalam praktiknya, transfer elektron akan selalu mengubah bilangan oksidasi, tetapi terdapat banyak reaksi yang diklasifikasikan sebagai "redoks", walaupun tidak ada transfer elektron dalam reaksi.