
Reaksi berikut yang menunjukkan reaksi redoks adalah....
Materi Reaksi Redoks : Pengertian, Ciri, Fungsi, Aturan, Penyetaraan & Contohnya [LENGKAP] - Pengertian Reaksi Redoks adalah sebuah istilah yang menjelaskan adanya suatu perubahan bilangan. aq) + 6 CO2(g) (reaksi telah setara) Contoh Reaksi Redoks. 1. Sebagai Pengikatan dan Pelepasan Oksigen. ch4, tentukan biloks dari atom-atom berikut.

Penyetaraan Reaksi Redoks Cara Setengah Reaksi YouTube
Deskripsi Singkat Artikel ini akan membahas tentang reaksi redoks dan beberapa contoh reaksi redoks yang telah setara. Reaksi redoks merupakan reaksi kimia yang melibatkan perpindahan elektron antara dua spesies kimia, yaitu oksidasi dan reduksi. Setara berarti kedua reaksi tersebut memiliki jumlah elektron yang sama. Dalam artikel ini, Anda akan mempelajari prinsip reaksi redoks, contoh.

Gas Klorin Dapat Dibuat Melalui Reaksi Redoks Berikut
Pembahasan. Reaksi redoks yang setara adalah reaksi redoks yang jumlah atom dan jumlah muatan di ruas kiri sama dengan jumlah atom dan jumlah muatan di ruas kanan. Reaksi redoks yang setara yaitu pada reaksi: Karena: Jumlah semua unsur pada ruas kanan dan ruas kiri sama. Jumlah muatan pada ruas kanan dan ruas kiri sama.

Menyetarakan Reaksi Redoks dengan cara setengah reaksi YouTube
6. Menggabungkan kedua setengah-reaksi yang sudah setara tersebut menjadi satu persamaan reaksi, lalu menghilangkan jumlah spesi-spesi yang sama pada kedua sisi. Untuk reaksi redoks dalam larutan suasana basa: 7. Menambahkan OH − (aq) pada reaktan dan produk dengan jumlah sesuai dengan jumlah H + (aq) 8.

Pengertian Reaksi Redoks dalam Pembelajaran, Ini Penjelasannya
Pengertian Reaksi Redoks. Reaksi redoks adalah jenis reaksi kimia di mana terjadi pertukaran elektron antara atom atau molekul yang terlibat. Istilah "redoks" sendiri berasal dari singkatan "reduksi-oksidasi.". Reaksi redoks sangat penting dalam kimia dan berbagai aspek kehidupan sehari-hari.

Persamaan reaksi berikut yang sudah setara adalah... YouTube
Contoh persamaan suatu reaksi gas hidrogen dengan gas oksigen dihasilkan uap air, adalah sebagai berikut: Cara penulisan reaksi atau rumus persamaan reaksi adalah sebagai berikut: Tulis rumus kimia reaktan, produk dan wujud zat (larutan dalam pelarut air (aq), padatan (s), lelehan/cairan ($\ell$), gas (g).

Setarakan reaksi redoks berikut ini dengan metode setenga...
Latihan Soal Penyetaraan Reaksi Redoks (Sedang) Pertanyaan ke 1 dari 5. 1. Pertanyaan. Reaksi setengah oksidasi dari reaksi berikut dalam kondisi asam adalah. . Br2 → BrO − 3 + Br −. 1. 2BrO − 3 + 6H2O + 10e → Br2 + 12OH −. 2.

Konsep Reaksi Redoks
Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.
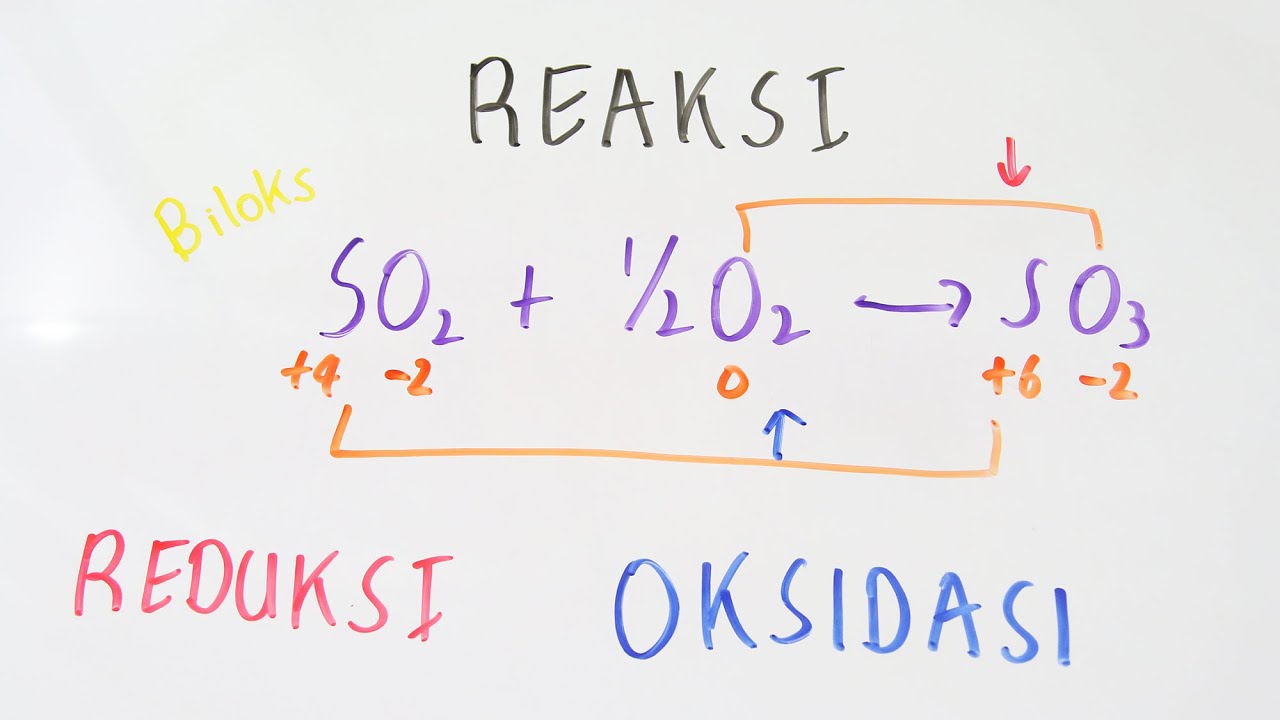
Reaksi redoks YouTube
Penerapan Reaksi Redoks dalam Kehidupan Sehari-Hari. Di awal artikel, gue sempet mention beberapa contoh, lalu bagaimana nih penerapan reaksi redoks dalam kehidupan sehari sehari. Nah, supaya elo gampang mengingat, gue udah buat daftar contohnya berikut ini: Pembakaran. Tahu nggak sih, oksigen yang ada di atmosfer bumi itu mengalami penurunan.
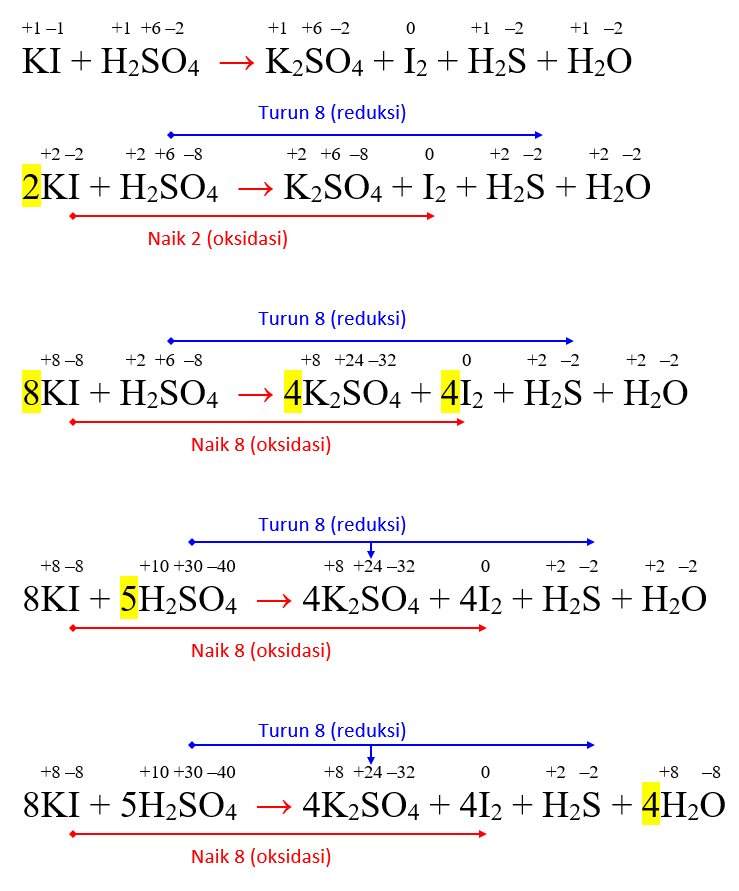
Penyetaraan Reaksi Redoks KI + H2SO4 → K2SO4 + I2 + H2S + H2O Markas Belajar
Reaksi redoks adalah reaksikimia yang menyebabkan adanya perubahan bilangan oksidasi pada suatu unsur, maupun molekul. Dalam kehidupan sehari-hari seringkali terjadi reaksi redoks. Diantaranya adalah besi yang berkarat, sayuran yang membusuk. Berikut penjelasan lengkap mengenai reaksi redoks

Diketahui reaksi redoks setara berikut; 3As + 5NO3^ + 4O...
Berdasarkan hal tersebut, maka persamaan reaksi redoks yang sudah setara pada suasana basa adalah: 2MnO + 5PbO 2 + 4H 2 O → 2MnO 4 - + 5Pb 2+ + 8OH - Cara Setengah Reaksi. Berikut langkah-langkah penyetaraan reaksi redoks dengan cara setengah reaksi: Setarakan jumlah atom yang terlibat dalam reaksi, kecuali atom O dan H.

Reaksi Berikut Yang Merupakan Reaksi Redoks Adalah Blog Sekolah
Pengertian Reaksi Redoks. Reaksi Redoks adalah istilah yang menjelaskan perubahan pada bilangan oksidasi atau keadaan oksidasi atom-atom dalam sebuah reaksi kimia. Hal ini bisa berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen yang menghasilkan metana (CH4), ataupun.

Setarakan persamaan reaksi redoks berikut menggunakan car...
Langkah 2: Setarakan unsur selain O dan H. Dalam kasus ini, hanya Cr yang perlu disetarakan. Cr 2 O 72-(aq) → 2Cr 3+(aq) HNO 2 (aq) → NO 3-(aq) Langkah 3: Tambah H 2 O untuk menyetarakan oksigen. Reaksi chromium membutuhkan 7H 2 O untuk bisa setara. Reaksi yang lain, hanya membutuhkan 1H 2 O untuk setara.

Diantara reaksi redoks berikut ini yang sudah setara adal...
Konsep Reaksi Redoks - Contoh, Cara Menentukan Biloks dan Tatanama - Materi dasar redoks dipelajari pada kelas 10 SMA semester 2 dimana akan dilanjutkan juga nantinya pada kelas 12 lebih mendalam tentang penyetaraan reaksi redoks. Reaksi redoks adalah reaksi yang melibatkan reaksi reduksi dan reaksi oksidasi.
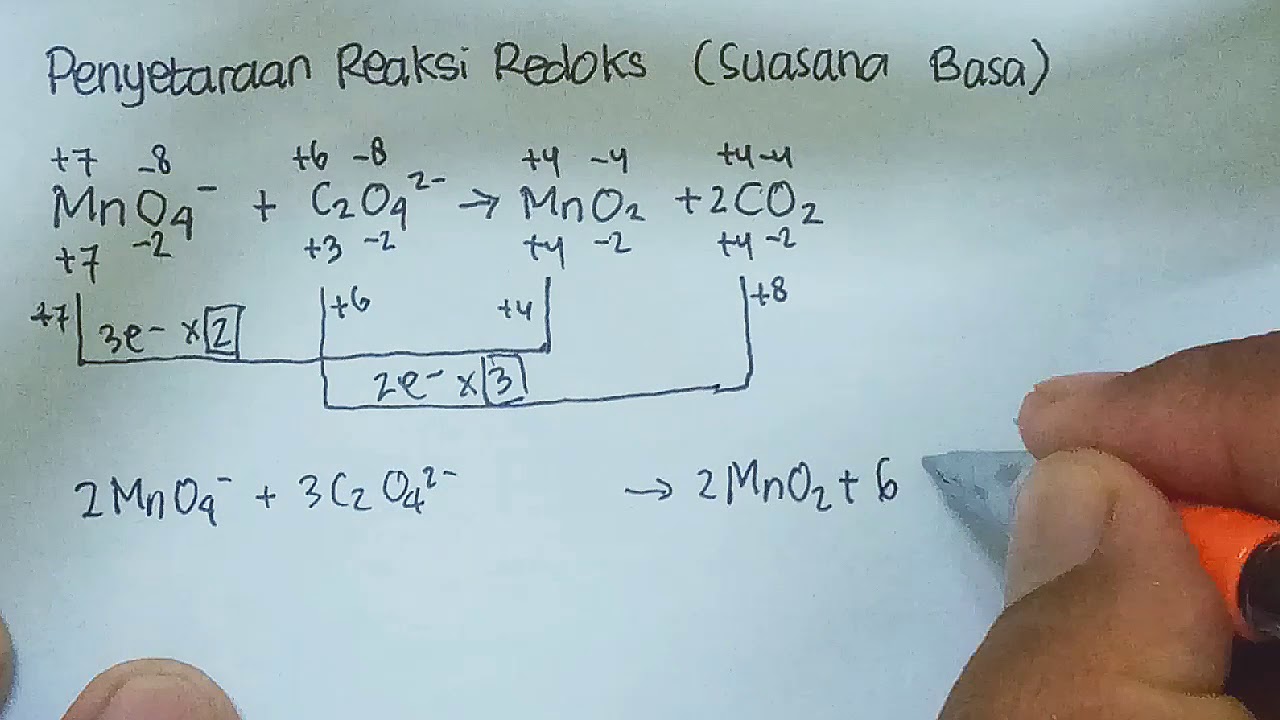
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Jakarta - . Reaksi redoks adalah reaksi kimia yang terjadi dari gabungan reduksi dan reaksi oksidasi. Reaksi redoks mencakup semua proses kimia, di mana atom melibatkan perubahan keadaan bilangan oksidasi (biloks). Pada suatu reaksi kimia yang lengkap, reaksi oksidasi akan selalu diikuti oleh reaksi reduksi, sehingga reaksi yang terjadi dikenal dengan istilah reaksi redoks.

Reaksi Kimia Di Bawah Ini Yang Merupakan Reaksi Redoks Adalah Terbaru
Pemahaman Akhir. Reaksi redoks merupakan reaksi yang terdiri dari reduksi (penerimaan elektron) dan oksidasi (penyisihan elektron). Konsep reaksi redoks dapat dilihat dari berbagai sudut pandang, seperti berdasarkan pengikatan dan pelepasan oksigen, pengikatan dan pelepasan elektron, atau penambahan dan penurunan bilangan oksidasi.