
Rumus Tabung Luas, Volume dan Contoh Soal Nekopencil
Materi pelajaran Kimia untuk SMA Kelas 10 IPA bab Hukum-Hukum Dasar Kimia ⚡️ dengan Hukum Perbandingan Volume, bikin belajar mu makin seru dengan video belajar beraminasi dari Ruangbelajar. Home;. Soal Penentuan Rumus Molekul Gas. 125. 10. Kuis 7 Hukum Perbandingan Volume. 50. 50. Soal Penentuan Volume Gas Campuran. 125. 10. Kuis 8 Hukum.

Rumus Hukum Charles Teori Gas Fisika Kelas Quipper Blog The Best Porn Website
Nah, pada artikel kali ini gue mau ngebahas secara detail, nih, mengenai bunyi hukum Gay Lussac, rumus hingga contoh soalnya. Hukum Gay Lussac ini adalah salah satu materi yang akan elo temui dalam mata pelajaran Kimia kelas 11. Selain soda, contoh lain dalam kehidupan sehari-hari adalah kalo elo tengah malam gitu merasa lapar.

hukum gay lussac , perbandingan volume, UN kimia 2016 pembahasan 13 YouTube
Materi pelajaran Kimia untuk Kelas 10 Kurikulum Merdeka bab Hukum Dasar Kimia di Sekitar Kita: Hukum Perbandingan Volume ⚡️ dengan Hukum Perbandingan Volume, bikin belajar mu makin seru dengan video belajar beraminasi dari Ruangbelajar. Home;. Video ini membahas soal penentuan rumus molekul gas.

Hukum Perbandingan Volume Gay Lussac [Hukum Dasar kimia] YouTube
Video berisi penjelasan mengenai hukum perbandingan volume atau hukum Gay Lussac dilengkapi dengan contoh soal dan cara pengerjaan supaya lebih mudah dipaham.

32+ Contoh Soal Hukum Bernoulli Kelas 11 Contoh Soal Terbaru
Hukum perbandingan volume. Hukum perbandingan volume atau hukum Gay Lussac adalah sebuah hukum kimia yang menyatakan bahwa sejumlah gas yang direaksikan dengan volume konstan atau tetap akan berbanding lurus dengan nilai suhunya. [1] Saat suhu gas dalam sebuah wadah yang kaku dinaikkan, maka tekanan dari gas tersebut akan ikut meningkat.

Hukum perbandingan volume yang dinyatakan oleh Gay Lussac...
Tentukan berapa perbandingan jumlah volume gas yang terlibat dalam reaksi tersebut! Pembahasan: a). 2 : 3 = 2. b). Dikarenakan perbandingan jumlah volume dan mol suatu gas pada tekanan dan suhu yang sama bersifat sama pula, maka. 2 : 3 = 2. Jadi, perbandingan jumlah volume gas yang terlibat dalam reaksi tersebut sama dengan perbandingan jumlah.

Rumus Volume Tabung Dengan Diameter Cara Mudah Menghitung Volume Tabung Dengan Diameter Sebagai
10. Kuis 8 Hukum Perbandingan Volume. 50. 50. Rangkuman Hukum Perbandingan Volume. Kuis Akhir Hukum Perbandingan Volume. 675. 300. Materi pelajaran IPA untuk Kelas 10 Kurikulum Merdeka bab Hukum Dasar Kimia dengan Hukum Perbandingan Volume, bikin belajar mu makin seru dengan video belajar beraminasi dari Ruangbelajar.

7 Rumus Dan Cara Mencari Volume Bangun Ruang Matematika Riset Vrogue
Latihan Soal Hukum Gay Lussac (Sedang) 1. Pertanyaan. Untuk membakar campuran gas etana (C2H6) ( C 2 H 6) dan gas propana (C3H8) ( C 3 H 8) diperlukan 18 18 L gas oksigen. Jika pada P dan T yang sama, dihasilkan 10, 5 10, 5 L gas karbon dioksida. Berapakah volume etana dan propana berturut-turut. . 1.

Hukum Dasar Kimia Kelas 10 • Part 4 Hukum Perbandingan Volume (GayLussac) & Hipotesis Avogadro
Dari percobaannya, Gay Lussac menyimpulkan Hukum Perbandingan Volume yang berbunyi, "Pada Suhu dan Tekanan yang sama volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana." Rumus hukum Gay Lussac adalah sebagai berikut: V1/V2 = n1/n2 Contoh Penerapan Hukum Gay Lussac
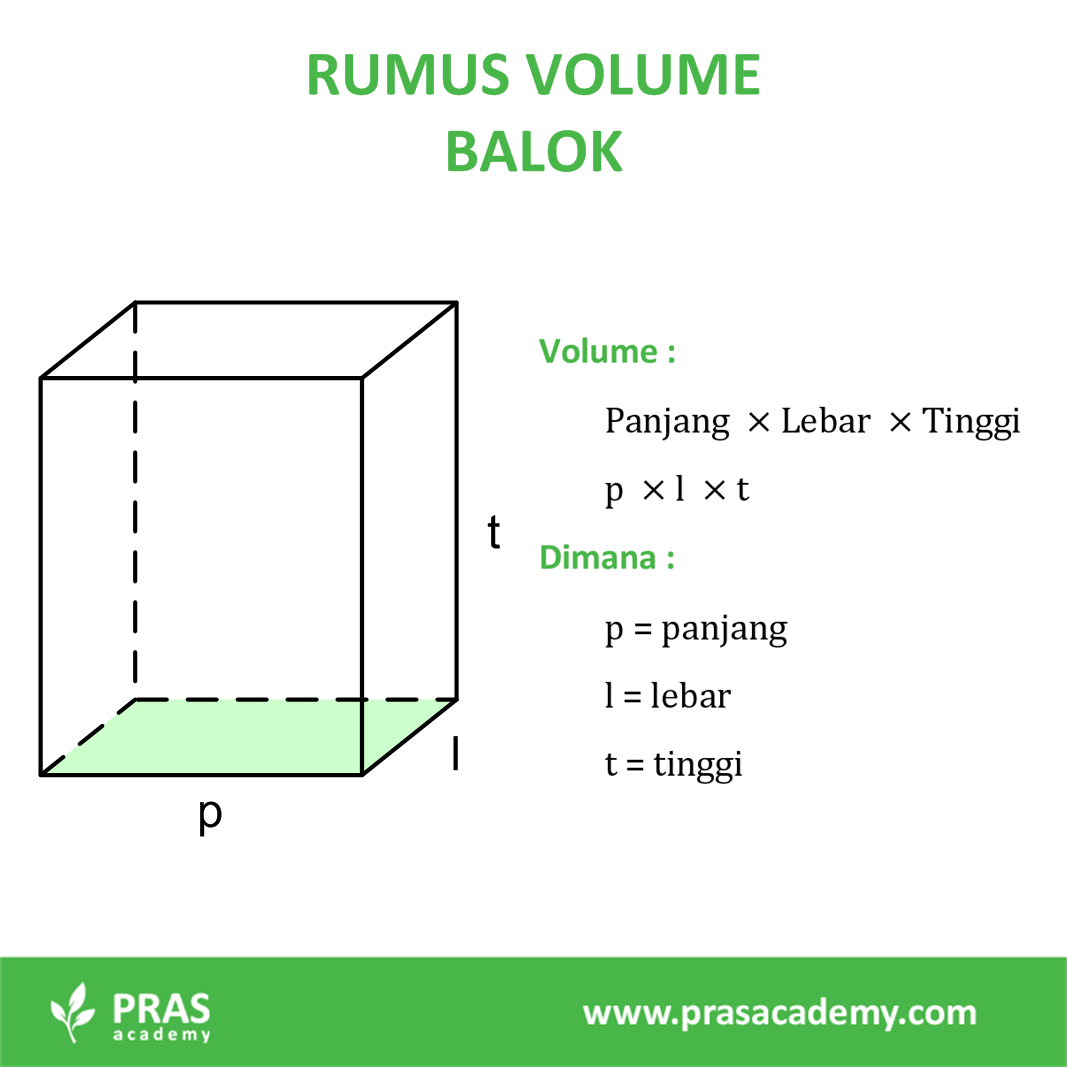
Pras Academy SMP Rumus Volume Bangun Ruang
Hukum Perbandingan Volume (Gaylussac) - Konsep, Bunyi dan Soalnya. Hukum Perbandingan Volume (Gaylussac) - Konsep, Bunyi dan Contoh Soal - Pada awalnya para ilmuwan menemukan bahwa gas hidrogen dapat bereaksi dengan gas oksigen membentuk air. Perbandingan volume gas hidrogen dan oksigen dalam reaksi tersebut tetap, yakni 2 : 1.

Rumus Volume Dan Luas Permukaan Setengah Bola Cilacap Klik
Hukum Perbandingan Volume-Bila diukur pada suhu dan tekanan yang sama akan berbanding sebagai bilangan bulat dan sederhana. Follow. Mardinata.. Dit: Rumus kimia gas NaOb. Jawab: Langkah Pertama: Perabandingan koefisien = perbandingan volume. Koefisien N 2: O 2: NaOb = 10 : 15 : 10 = 2 : 3 : 2.

Hukum Perbandingan Volume (Hukum GayLussac)Pembelajaran Mikro YouTube
Koefisien A. Koefisien B. Untuk lebih jelasnya, berikut ini diberikan beberapa contoh hukum perbandingan volume yang disertai pembahasannya. Contoh soal 1. Lima liter gas asitilena dibakar sempurna sesuai dengan persamaan reaksi berikut: 2 C2H2 (g) + 5 O2 (g) → 4 CO2 (g) + 2 H2O (g) Pada suhu dan tekanan sama, tentukan:

Hukum Perbandingan Volume Peatix
Contoh Soal dan Pembahasan. Soal 1. Setiap 2 liter gas nitrogen tepat habis bereaksi dengan 3 liter gas oksigen menghasilkan 1 liter gas oksida nitrogen. Jika volume diukur pada suhu dan tekanan yang sama, tentukan rumus molekul oksida nitrogen tersebut. Jawaban : Menurut hukum Gay-Lussac : perbandingan volume = perbandingan koefisien, sehingga.

Persamaan Boyle Gay lussac dan penjelasan isobarik isotermal isokhorik adiabatik dan contoh soal
Dilansir dari Chemistry LibreTexts, hukum perbandingan volume Gay Lussac berbunyi: "Ketika gas bergabung pada suhu dan tekanan konstan, perbandingan volume gas-gas yang terlibat selalu dalam rasio bilangan bulat sederhana". Artinya perbandingan antara volume gas-gas reaktan dan produk dapat dinyatakan dalam perbandingan bilangan bulat.

Rumus molekul dari perbandingan volume kimia SMA YouTube
Adapun bunyi hukum Gay Lussac (hukum perbandingan volume) adalah sebagai berikut:. Menurut hukum Gay Lussac, rasio tekanan dan suhu awal sama dengan tekanan dan suhu akhir gas pada massa dan volume konstan sehingga rumus hukum ini adalah: P1T1 = P2T2. Keterangan: P 1 = Tekanan mula-mula ( Pa, atm atau N/m 2)
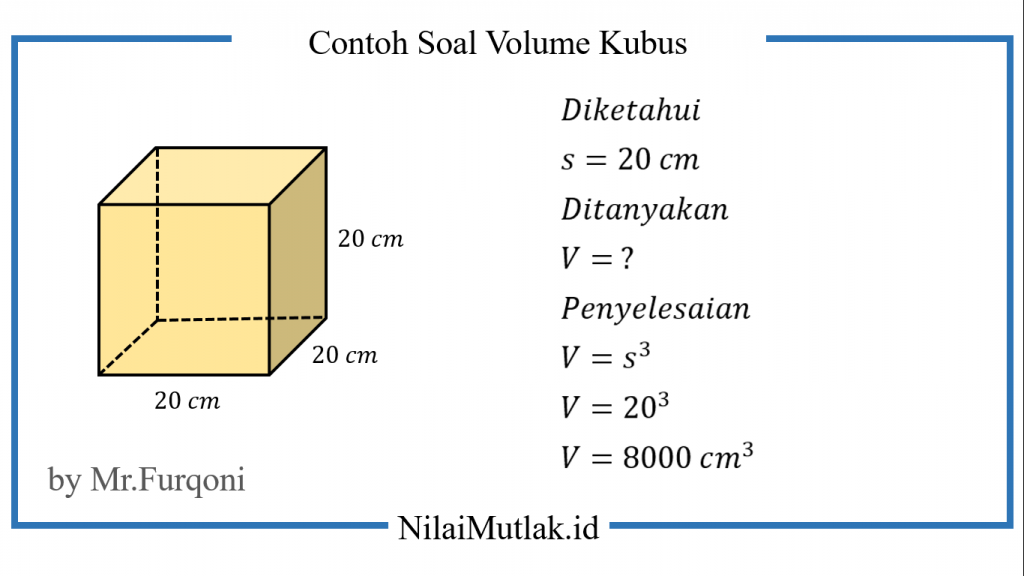
Rumus Volume Kubus Beserta Cara Menghitung Contoh Soalnya My Riset
Hukum Gay-Lussac (Hukum Perbandingan Volume) - Sebelum lahirnya hukum Gay-Lussac, beberapa hasil percobaan sebelumnya yang ada kaitannya dengan hukum perbandingan volume Gay-Lussac.Di awal tahun 1781 Joseph Priestley (1733-1804) menemukan hidrogen dapat bereaksi dengan oksigen membentuk air, kemudian Henry Cavendish (1731-1810) menemukan volume hidrogen dan oksigen yang bereaksi membentuk.