
WANIBESAK Laju Reaksi, Koefisien Reaksi dan Persamaan Laju Reaksi
Cuaca & Iklim Diperbarui pada 16 April 2019 Pada tahun 1889, Svante Arrhenius merumuskan persamaan Arrhenius, yang menghubungkan laju reaksi dengan suhu . Sebuah generalisasi luas dari persamaan Arrhenius adalah mengatakan bahwa laju reaksi untuk banyak reaksi kimia berlipat ganda untuk setiap kenaikan 10 derajat Celcius atau Kelvin.
Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11
Konstanta laju adalah faktor proporsionalitas dalam hukum laju kinetika kimia yang menghubungkan konsentrasi molar reaktan dengan laju reaksi. Ini juga dikenal sebagai konstanta laju reaksi atau koefisien laju reaksi dan ditunjukkan dalam persamaan dengan huruf k . Takeaways Utama: Nilai Konstan

prediksi un kmia 2018 , paket A pembahasan no 15, menentukan konstanta laju reaksi YouTube
Laju reaksi adalah perubahan konsentrasi reaktan atau produk per satuan waktu. Besaran laju reaksi dilihat dari ukuran cepat lambatnya suatu reaksi kimia. Laju reaksi mempunyai satuan M/s (Molar per detik ). [1] Laju reaksi dilambangkan dengan v atau r.

PPT REAKSI PowerPoint Presentation, free download ID3346182
Konstanta laju reaksi Dalam kinetika kimia suatu konstanta laju reaksi atau koefisien laju reaksi, k, mengukur (mengkuantifikasi) laju dari suatu reaksi kimia. [1] Bagi suatu reaksi antara reaktan A dan B untuk menghasilkan produk C a A + b B → c C laju reaksinya terkadang memiliki persamaan :

Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11 Belajar Gratis di Rumah
From Wikipedia, the free encyclopedia Dalam kinetika kimia suatu konstanta laju reaksi atau koefisien laju reaksi, k, mengukur (mengkuantifikasi) laju dari suatu reaksi kimia. Bagi suatu reaksi antara reaktan A dan B untuk menghasilkan produk C a A + b B → c C laju reaksinya terkadang memiliki persamaan:

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI DARI TABEL PERCOBAAN YouTube
Laju reaksi merupakan peristiwa perubahan konsentrasi reaktan atau produk dalam satuan waktu. Laju reaksi juga dapat dinyatakan sebagai suatu laju terhadap berkurangnya konsentrasi suatu pereaksi. Konstanta laju reaksi merupakan laju reaksi bila konsentrasi dari masing-masing jenis adalah satu (Keenan, 1984).

Contoh Soal Laju Reaksi YouTube
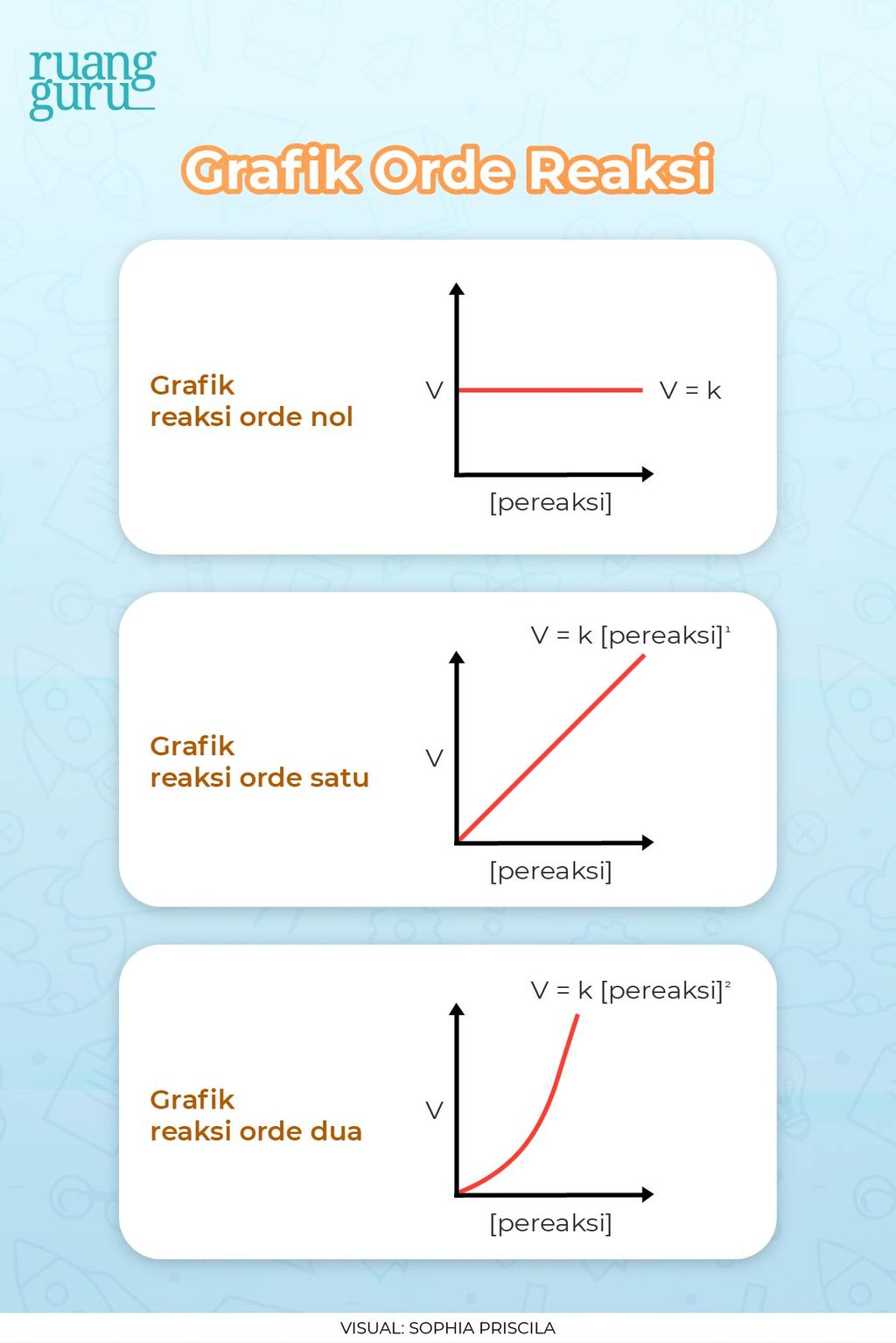
Suatu data eksperimental digunakan dalam penentuan laju suatu reaksi dimana hukum laju dan konstanta laju reaksi ini diperoleh dari penerapan hukum aksi massa. Hukum laju ini mengatur perhitungan sederhana untuk reaksi dengan orde 0, orde 1 dan orde 2:

Laju Reaksi Kimia Rumus Bit CDN
Persamaan Laju Reaksi. Bila diketahui suatu reaksi: lA + mB → nC + oD. Maka persamaan lajunya dapat dinyatakan sebagai. v = k[A]x[B]y. dimana, k = tetapan jenis reaksi. x = orde (tingkat atau pangkat) reaksi terhadap pereaksi A. y = orde (tingkat atau pangkat) reaksi terhadap pereaksi B.

Contoh Soal Laju Reaksi Sma Contoh Terbaru
Persamaan Laju Reaksi. Dalam laju reaksi, umumnya penyebutan satuan dinyatakan dengan M/s (molaritas per detik) atau yang disebut juga dengan molaritas. Molaritas itu sendiri ialah ukuran yang menyatakan banyak mol zat terlarut dalam satu liter larutannya. Kamu tahu nggak bahwa laju reaksi juga memiliki persamaan, lho.

contoh soal laju reaksi kimia dan pembahasannya Perhitungan kimia
Konstanta k merupakan tetapan laju reaksi atau koefisien laju reaksi. Nilai koefisien k ini dapat bergantung pada kondisi seperti suhu, kekuatan ionik, luas permukaan dari suatu adsorben, atau iradiasi cahaya. Reaksi elementer

Hukum Laju Reaksi
(Reaktan) (Produk) Di mana, v= laju reaksi (mol/L/s); = perubahan mol; = perubahan waktu atau, Di mana, v= Laju reaksi (mol/L/s) ; k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A. Secara logika, pada saat bereaksi, zat reaktan pasti makin berkurang, dan zat produk pasti bertambah bukan?

Satuan Tetapan Laju Reaksi K Untuk Reaksi Orde 2 Adalah
Laju reaksi merupakan perubahan konsentrasi dari reaktan atau produk terhadap waktu (satuan M/s). Beberapa reaksi yang terjadi di alam ada yang berlangsung sangat cepat atau sangat lambat. Contoh reaksi yang berlangsung sangat cepat yaitu reaksi fotosintesis dan reaksi berantai nuklir yang memerlukan rentang waktu 10 -12 s sampai 10 -16 s.

Pengertian dan Teori Laju Reaksi Materi Kimia Kelas 11
tirto.id - Laju reaksi adalah laju berkurangnya kosentrasi pereaksi atau laju bertambahnya konsentrasi hasil reaksi tiap satuan waktu. Secara sederhana, laju reaksi diartikan sebagai perubahan konsentrasi pereaksi (reaktan) atau reaksi (produk) persatuan waktu.

Satuan Tetapan Laju Reaksi K Untuk Reaksi Orde 2 Adalah
Laju reaksi mempunyai satuan konsentrasi dibagi waktu. Maka yang paling mudah untuk satuan laju reaksi adalah molar per detik (M/s). Konstanta Laju Reaksi. Pada suhu tetap, laju reaksi tergantung pada konsentrasi reaktan. Hubungan yang pasti antara konsentrasi dan laju reaksi ditentukan dengan mengukur laju reaksi dengan perbedaan konsentrasi.

(PDF) Data Fitting untuk menentukan orde dan konstanta laju reaksi · Rumus Umum Satuan k. Metode
Laju reaksi adalah perubahan konsentrasi dari reaktan ataupun produk per satu satuan waktu. Untuk reaksi dengan reaktan A dan B menghasilkan produk C dan D seperti pada rumus persamaan reaksi berikut, seiring waktu jumlah molekul reaktan A dan B akan berkurang dan jumlah molekul produk C dan D akan bertambah, dan rumus laju reaksi (v) yaitu:

Persamaan Laju Reaksi dan Orde Reaksi Laju Reaksi Kimia Kelas 11 YouTube
Konstanta laju reaksi atau tetapan laju reaksi adalah tetapan yang harganya bergantung pada jenis pereaksi, suhu dan katalis. Tetapan laju reaksi berbanding terbalik dengan perubahan waktu. Semakin cepat reaksi berlangsung, maka harga tetapan laju reaksi semakin besar. Dan berbanding lurus dengan perubahan suhu.