
Kelompok senyawa kovalen berikut yang bersifat non polar
A. Ikatan Kovalen Polar Ikatan kovalen polar adalah ikatan kovalen yang mengalami pengkutuban atau polarisasi yang disebabkan karena kepadatan elektron berkumpul di sekitar atom yang memiliki keelektronegatifan tinggi dan menjadikannya lebih negatif dari bagian lain. Contoh ikatan kovalen polar yaitu: 1. Ikatan Kovalen Polar H2O (Air) 2. Ikatan Kovalen Polar HCl (Asam klorida) 3.
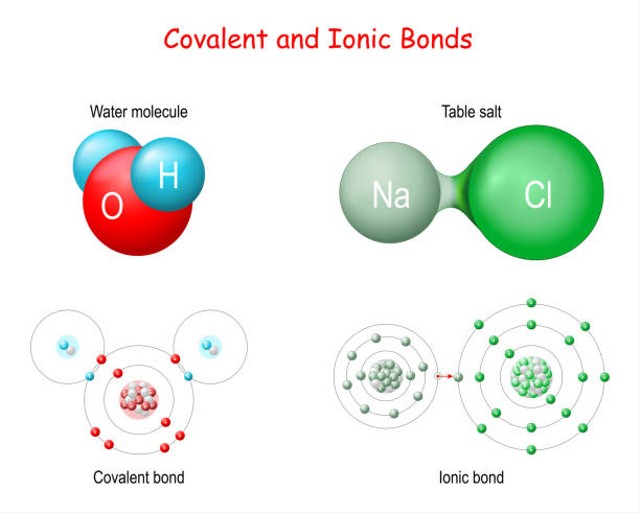
Perbedaan Senyawa Ionik dan Senyawa Kovalen Polar
Tidak terdapat pasangan elektron bebas, seperti CCl 4, PCl 5, dan SF 6. Senyawa CH 4 atau metana juga termasuk salah satu ikatan kovalen non polar. Senyawa ini memiliki bentuk yang simetris, artinya tidak ada pasangan elektron bebas pada struktur molekul lewisnya. Selain itu, selisih nilai keelektronegatifan atom C dan atom H juga kurang dari 0,5.

Ikatan Kovalen Polar Dan Nonpolar Beserta Contoh Ikatannya Rumus Kimia Sexiz Pix
Dilansir dari Sciencing, senyawa polar memiliki beberapa sifat, yaitu: Senyawa polar memiliki muatan positif dan negatif parsial. Saat berikatan, atom dapat saling berbagi electron atau kovalen atau melepaskan elektron atau ionik. Perbedaan anatar molekul polar dan nonpolar ditentukan oleh vektor muatan parsial yang dihasilkan dari setiap ikatan.

🔴IKATAN KOVALEN POLAR & NON POLAR, 🔴SENYAWA KOVALEN POLAR DAN SENYAWA KOVALEN NONPOLAR YouTube
Ciri - Ciri Senyawa Polar. Ada beberapa ciri-ciri senyawa polar yang diantaranya yaitu: Dapat larut dalam air dan pelarut polar lain. Memiliki kutub + dan kutub - akibat tidak meratanya distribusi elektron. Memiliki pasangan elektron bebas "apabila bentuk molekul diketahui" atau memiliki perbedaan keelektronegatifan.

15 10 Contoh Senyawa Polar Dan Nonpolar
Contoh senyawa kovalen polar adalah NH 3,PCl 3, H 2 O, dan Cl 2 O. Perhatikan struktur Lewis untuk senyawa PCl 3 dan H 2 O berikut: 2. Ikatan Kovalen Non Polar. Perhatikan struktur salah satu ikatan kovalen non Polar dari CH 4 berikut: Lihat juga materi kimia lainnya: Hidrolisis Garam dari Asam lemah dan Basa Kuat.

Contoh Senyawa Kovalen Polar Format Soal
Contoh ikatan kovalen polar adalah senyawa HF. Atom H memiliki elektronegativitas 2,20. dan atom F memiliki elektronegativitas 3,98. Artinya terdapat perbedaan elektronegativitas sebesar 1,78. Sedangkan, ikatan kovalen nonpolar adalah ikatan kovalen yang terbentuk antara atom-atom yang tidak memiliki perbedaan elektronegativitas. Contoh ikatan.
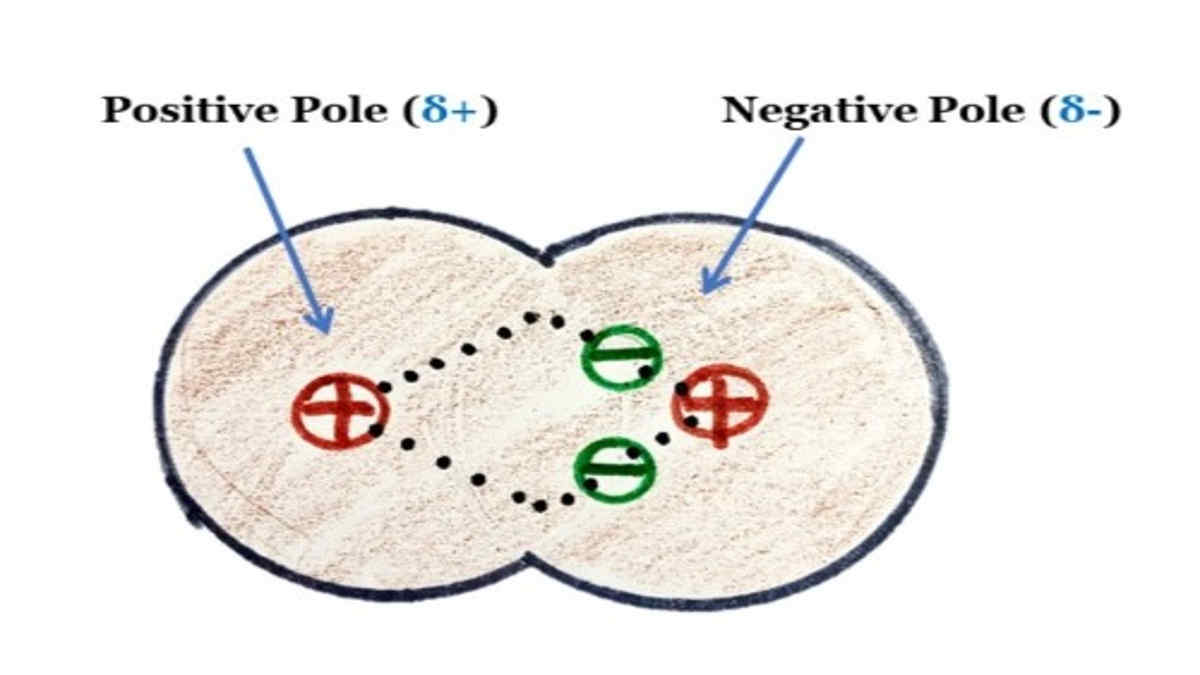
Senyawa Kovalen Polar Pengertian, Sifat, Ciri Beserta Contohnya
senyawa kovalen polar dan nonpolar yang abstrak dan belum dapat memotivasi siswa dalam belajar. Sehingga lebih banyak siswa kurang aktif dalam kegiatan pembelajaran. Penelitian yang dilakukan oleh Latifah, dkk (2014), menyatakan bahwa kegiatan praktikum dalam pembelajaran sangat diperlukan untuk membantu siswa memahami

ecochemical Senyawa Kovalen Polar dan NonPolar
Ikatan Kovalen Nonpolar, Polar dan Koordinasi. a. Ikatan kovalen nonpolar. Nah, bila dua buah atom atau unsur yang terikat dalam ikatan kovalen memiliki keelektronegatifan yang sama besar, maka tidak akan mengakibatkan pengutuban atau polarisasi muatan. Hal ini kemudian dinamakan sebagain ikatan kovalen nonpolar. Misalnya pada I 2 dimana.

Senyawa Kovalen Polar Dan Non Polar
Dari gambar struktur lewis di atas maka senyawa yang berikatan kovalen polar adalah senyawa NH 3, HF dan H 2 O sedangkan senyawa yang berikatan kovalen nonpolar adalah CH 4. Akan tetapi cara menggambarkan struktur lewis satu per satu terasa kurang efisien jika dalam soal terdapat lebih dari 5 jenis senyawa.

Membedakan Senyawa Kovalen Polar dan Nonpolar YouTube
Senyawa kovalen non polar juga biasanya memiliki bentuk gas atau cair pada suhu kamar. Baca juga: Ikatan Kovalen Koordinasi: Pengertian dan Contohnya. Ikatan kovalen non polar terjadi karena kesamaan keelektronegativan atom-atom yang saling terikat. Di mana jika perbedaan keelektronegativan dua atom di bawah 0,4.

Perbedan Senyawa Kovalen Polar dan NonPolar Kimia SMA dan SBMPTN Yusuf Studi
Pengertian Senyawa Non Polar. Dilansir dari Encyclopedia Britannica, senyawa non polar adalah senyawa yang tidak memiliki muatan listrik bersih (muatan negatif dan positifnya sama sehingga saling menghilangkan) dan memiliki susunan yang simetris. Artinya, enyawa non polar disebut simetris karena semua sisi atom pusatnya terikat pada elemen dan.
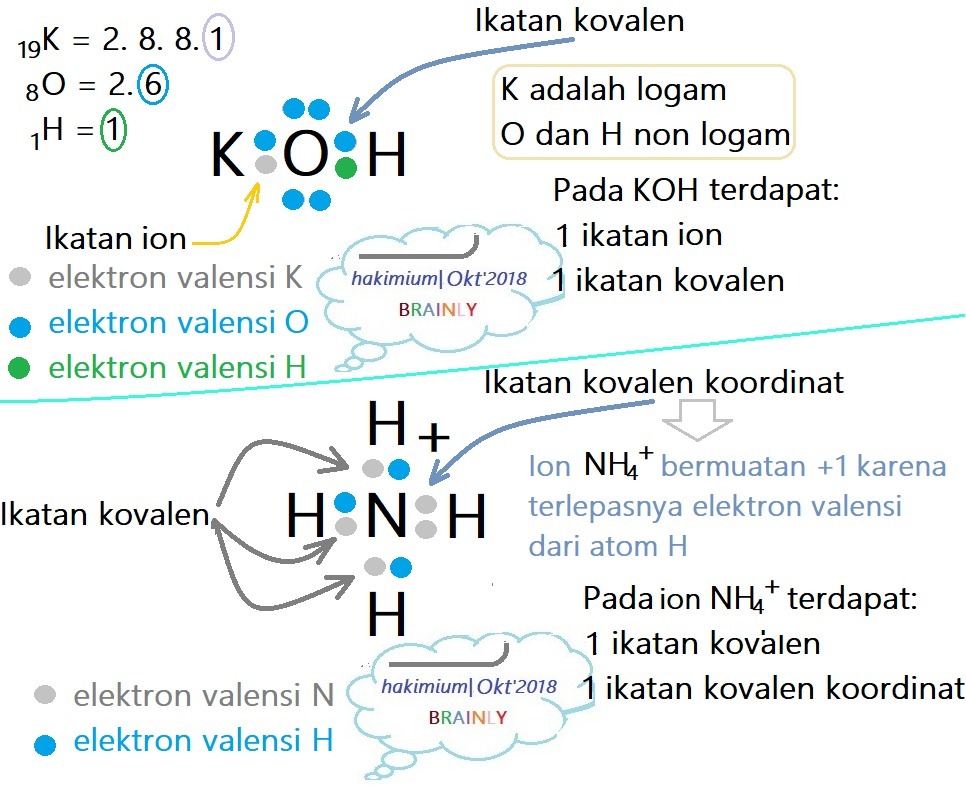
10 Contoh Soal Dan Pembahasan Ikatan Kovalen Polar Dan Nonpolar Materi Kimia Riset
dipengaruhi oleh perbedaan nilai keelektronegatifan. Jika antara atom-atom unsur penyusun senyawa memiliki perbedaan. keelektronegatifan yang kecil atau bahkan nol maka ikatan yang terbentuk adalah ikatan. kovalen nonpolar. Dan sebaliknya, jika perbedaan keelektronegatifan relatif besar maka.

Contoh Pelarut Polar Dan Nonpolar materisekolah.github.io
Supaya kamu lebih memahami tentang materi senyawa polar dan nonpolar, perhatikan contoh soal senyawa polar dan nonpolar berikut ini. Tentukan senyawa berikut termasuk senyawa polar atau nonpolar! 1. O2 6. SF4 2. HI 7. SF6 3. SiCl4 8. XeF2 4. HCl 9. XeF4 5. SF2 10. XeF6 Pembahasan Untuk dapat menentukan senyawa tersebut termasuk senyawa

Ikatan kovalen Polar dan Non Polar Alsen Saloka Blog's
Senyawa Kovalen Polar Menurut Para Ahli. Sifat Senyawa Kovalen Polar. Ciri Senyawa Kovalen Polar. 1.Terbentuk dari atom-atom yang memiliki perbedaan keelektronegatifan yang cukup besar. 2.Memiliki momen dipol. 3.Mudah larut. 4.Titik leleh dan didihnya yang rendah. 5.Bersifat elektrolit lemah. 6.Bersifat reaktif.
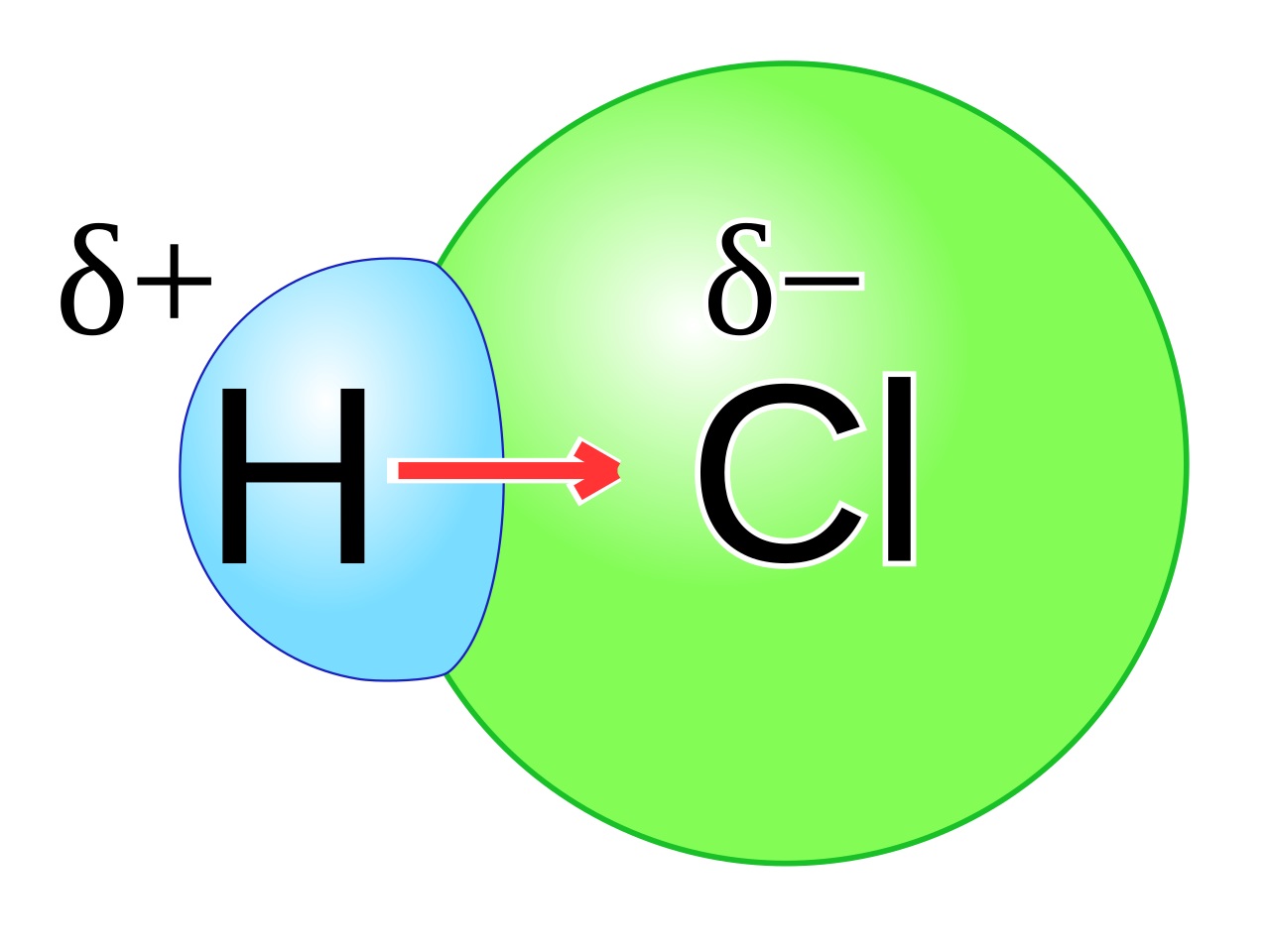
10 Contoh Ikatan Kovalen Polar dan Non Polar dalam Kehidupan Seharihari Materi Kimia
Pengertian Senyawa Non Polar Menurut Para Ahli. Senyawa non polar merupakan senyawa kimia yang memiliki ikatan kovalen antara atom-atom yang memiliki perbedaan keelektronegatifan yang kecil atau sama sehingga elektron-elektron dalam ikatan tersebut terdistribusi secara merata dan tidak terpolarisasi. Hal ini menyebabkan senyawa jenis non polar.

perbedaan senyawa ion kovalen polar kovalen non polar Sebastian Grant
Pelarutan Senyawa Ionik dan Kovalen. Ngomong-ngomong tentang larutan, terbentuknya itu kan karena adanya interaksi antara zat terlarut dan zat pelarut. Nah, yang namanya interaksi, berarti kita akan nyerempet-nyerempet ke jenis ikatan kimia, seperti ikatan ionik, kovalen, polar, dan nonpolar. Contohnya larutan garam (NaCl) dilarutkan oleh air.