
21+ Contoh Soal Menghitung Asam Basa Valeria Ashley
Teori Asam Basa Lewis.. Contoh Soal Asam Basa. Soal 1. Diberikan larutan yang memiliki pH 9. Apakah larutan tersebut bersifat asam, netral, atau basa? Jelaskan! Jawaban: Larutan dengan pH 9 bersifat basa. Skala pH berkisar dari 0 hingga 14, dan nilai pH di atas 7 menunjukkan sifat basa. Dalam hal ini, nilai pH 9 menunjukkan tingkat basa yang.

Soal dan Pembahasan Teori Asam Basa Kimia Kelas 11 Semester 1
Contoh Soal. 1. Tentukan manakah asam dan basa didalam reaksi asam basa berikut dengan cara memberikan alasan berdasarkan teori asam basa Brønsted-Lowry, Arrhenius, atau Lewis. Ni 2+ (aq) + 4CN - (aq) ⇌ [Ni(CN) 4] 2-(aq) Jawab: Teori Arrhenius serta teori Brønsted-Lowry tidak bisa menjelaskan reaksi diatas.

latihan soal UN Asam basa brondsted Lowry kimia SMA YouTube
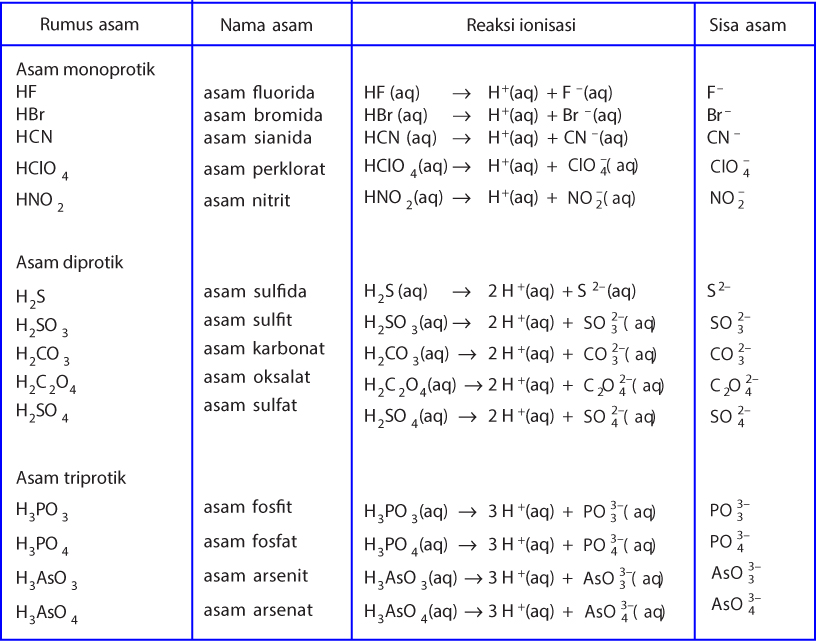
Suatu asam atau basa disebut kuat jika terurai sempurna (atau mendekati sempurna) di dalam air, kekuatan ini disebut juga dengan kekuatan ionisasi. Contoh asam kuat adalah: HCl, HBr, H 2 SO 4, HNO 3, HI, HIO4, dan HbrO4.Untuk basa kuat contohnya adalah: NAOH (natrium hidroksida), KOH (kalium hidroksida), Ba(OH) 2 dan juga yang berasal dari golongan alkali (golongan IA) seperti Na dan K, dan.

31++ Contoh Soal Tentang Asam Basa Konjugasi Contoh Soal Terbaru
Latihan Soal Teori Asam dan Basa kuis untuk 10th grade siswa. Temukan kuis lain seharga Chemistry dan lainnya di Quizizz gratis! 10 Qs . Simple Past Tense 10.5K plays 8th 10 Qs . Recount Text 7.9K plays 10th 15 Qs . Multiplication 4.3K plays 2nd - 6th 20 Qs . job 10.7K plays 4th Browse from millions of quizzes.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Rangkuman 1 Teori Asam-Basa Arrhenius. Rangkuman 2 Teori Asam-Basa Arrhenius. Kuis Akhir Teori Asam-Basa Arrhenius. 675. 300. Materi pelajaran Kimia untuk SMA Kelas 11 IPA bab Teori dan Karakteristik Asam-Basa ⚡️ dengan Teori Asam-Basa Arrhenius, bikin belajar mu makin seru dengan video belajar beraminasi dari Ruangbelajar.

Get Contoh Soal Asam Basa Menurut Arrhenius Gif
Soal Pembahasan Teori Asam Basa Nomor 6 rukim.id. Diketahui persamaan reaksi asam-basa Bronsted-Lowry berikut: H 2 PO 4- + H 2 O ⇌ H 3 PO 4 + OH-. H 2 PO 4- + H 2 O ⇌ PO 43- + H 3 O +. Berdasarkan teori asam-basa Bronsted-Lowry, sifat spesi H 2 O dalam kedua reaksi tersebut adalah.. A. Reaksi 1: bersifat asam karena.

Teori Asam Basa
1 - 15 Contoh Soal Asam Basa dan Jawaban. 1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . . a. Meningkatkan [H +] bila dimasukkan kedalam H 2 O. b. Menurunkan [H +] bila dimaasukkan kedalam H 2 O. d. Menerima 1 H + dari pasangan reaksinya.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.
Get Contoh Soal Asam Basa Menurut Arrhenius Gif
Video ini berisi tentang bagaimana cara menentukan Asam dan Basa berdasarkan teori asam basa Lewis. Ini adalah materi kimia kelas 11 IPA semester 2. Mohon ba.

Soal Soal Essay Asam Basa Kelas 11
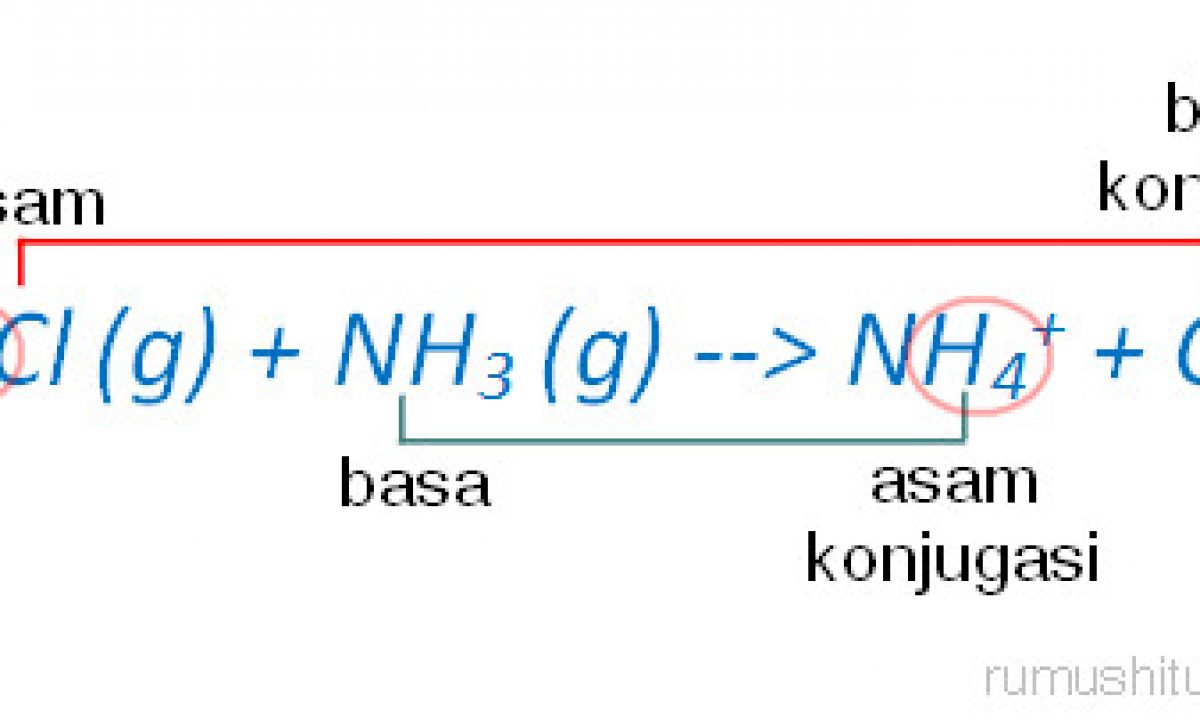
PEMBAHASAN : Pasangan asam- basa konjugasi adalah teori yang di cetuskan oleh Bronsted-Lowry. Dimana asam adalah zat yang memberikan/donor proton(H +) sehingga di akhir akan berkurang 1 H +.Sedangkan basa adalah penerima/akseptor proton(H +) sehingga di akhir akan bertambah 1H +.Jika dilihat dari reaksinya:
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Teori asam-basa Brønsted-Lowry. Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923.. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation.

XI.6.q. Teori Asam Basa Lewis (Teori) YouTube
Berdasarkan teori asam basa Arrhenius, HCN adalah asam Arrhenius sebagaimana HCN akan melepaskan ion H + jika dilarutkan dalam air. Berdasarkan teori Brønsted-Lowry, HCN adalah asam Brønsted-Lowry karena mendonorkan proton (H + ) sehingga menjadi ion CN − sedangkan H 2 O adalah basa Brønsted-Lowry karena menerima proton sehingga membentuk ion H 3 O + .

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Teori ini pertama kali dikemukakan oleh Ralph Pearson pada awal 1960-an dan merupakah salah satu teori asam basa menurut para ahli. Inti dari teori ini adalah menyatakan bahwa suatu asam lunak akan bereaksi lebih cepat dan membentuk ikatan yang lebih kuat dengan basa lunak, dan demikian pula sebaliknya untuk asam dan basa keras. Berikut ini.

LENGKAP ‼️ Teori Asam Basa Lewis Latihan Soal dan Pembahasan YouTube
Ini adalah salah satu contoh mengapa kita mempelajari teori asam basa contoh soal dalam kehidupan sehari-hari. Selain itu, dengan belajar mengenai indikator asam dan basa, kita juga dapat mengapa konsentrasi asam lambung dalam relatif tidak berubah meskipun kita banyak mengkonsumsi makanan dan minuman yang bereasa masam.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Berikut adalah contoh soal asam basa dalam bentuk pilihan ganda. Contoh soal asam basa ini telah kami lengkapi dengan kunci jawabannya. Selain itu, kamu juga bisa mendownload contoh soal asam basa ini lohh. Sehingga kamu akan lebih mudah mempelajari contoh soal asam basa ini. Soal No. 1 Menurut Arrhenius H2O bersifat netral karena.. . .
Contoh Soal Asam Basa Kimia SMA Kelas XI IPA YouTube
Baca Juga : 45+ Soal Asam Basa Pilihan Ganda dan Jawaban serta [+Pembahasan] 1. Pengertian Asam Basa. Asam dalam pelajaran kimia adalah senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7. Dalam definisi modern, asam adalah suatu zat yang dapat memberi proton (ion H +) kepada zat lain (yang disebut basa), atau dapat menerima pasangan elektron.