
Mengenal buffer dalam sel (Pasangan asambasa konjugasi H2PO4 dan HPO42) YouTube
Solusi ngerjain latihan soal Kimia kelas 11 materi Perkembangan Konsep Asam dan Basa. Bimbel; Paket UTBK-SNBT; Tanya;. Masuk. Kimia; Kimia Fisik dan Analisis Kelas 11 SMA; Asam dan Basa; Perkembangan Konsep Asam dan Basa; Tentukan pasangan asam-basa konjugasi dalam reaksi-reaksi berikut!a. HCO3^-(aq)+HCO3^-(aq) <-> H2 CO3(aq)+ CO3^2(aq) b.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Alkafirun pada saat kali ini telah disediakan sebuah reaksi bolak-balik dan kita diminta untuk menentukan pasangan asam basa konjugasinya sebelumnya pasangan asam basa konjugasi adalah pasangan asam basa yang berbeda 1 H plus Jadi jika ada sebuah asam X maka basa konjugat nya adalah x min 1 H plus dan jika ada basa maka asam konjugat nya adalah y ditambah 1 + untuk reaksi pada soal ini CH3COOH.
Sebutkan pasangan asambasa konjugasi dari reaksi berikut...
Video ini berisi tentang bagaimana cara menentukan pasangan asam basa konjugasi dari suatu reaksi asam basa Bronsted-Lowry. Ini adalah materi kimia kelas 11.
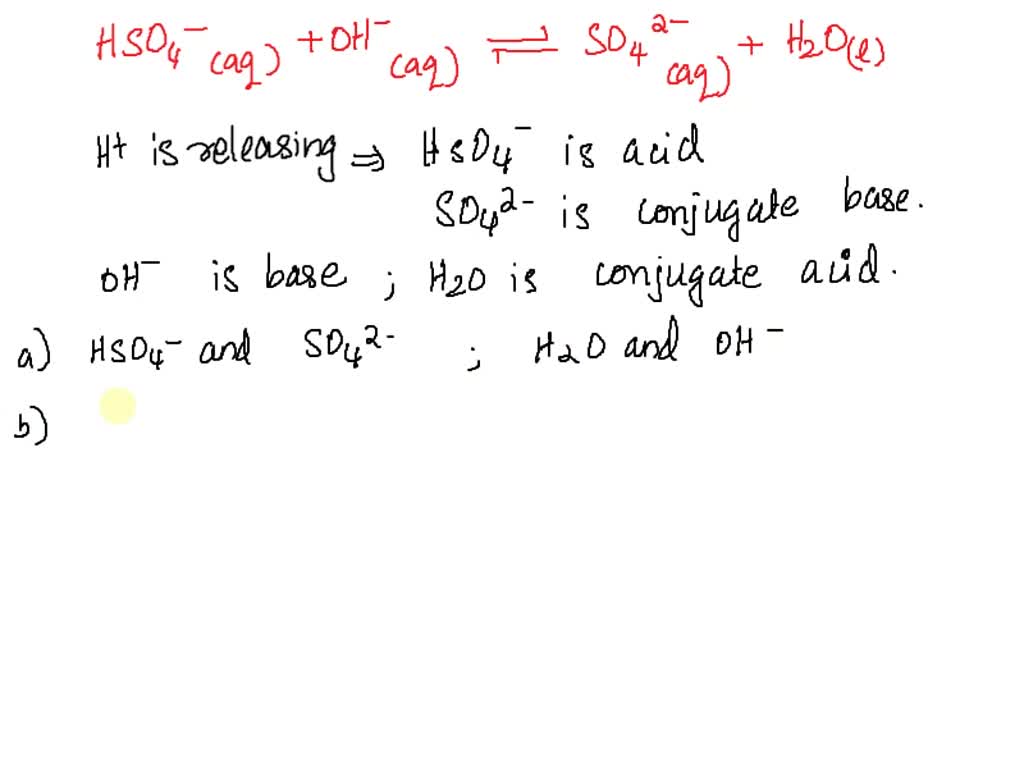
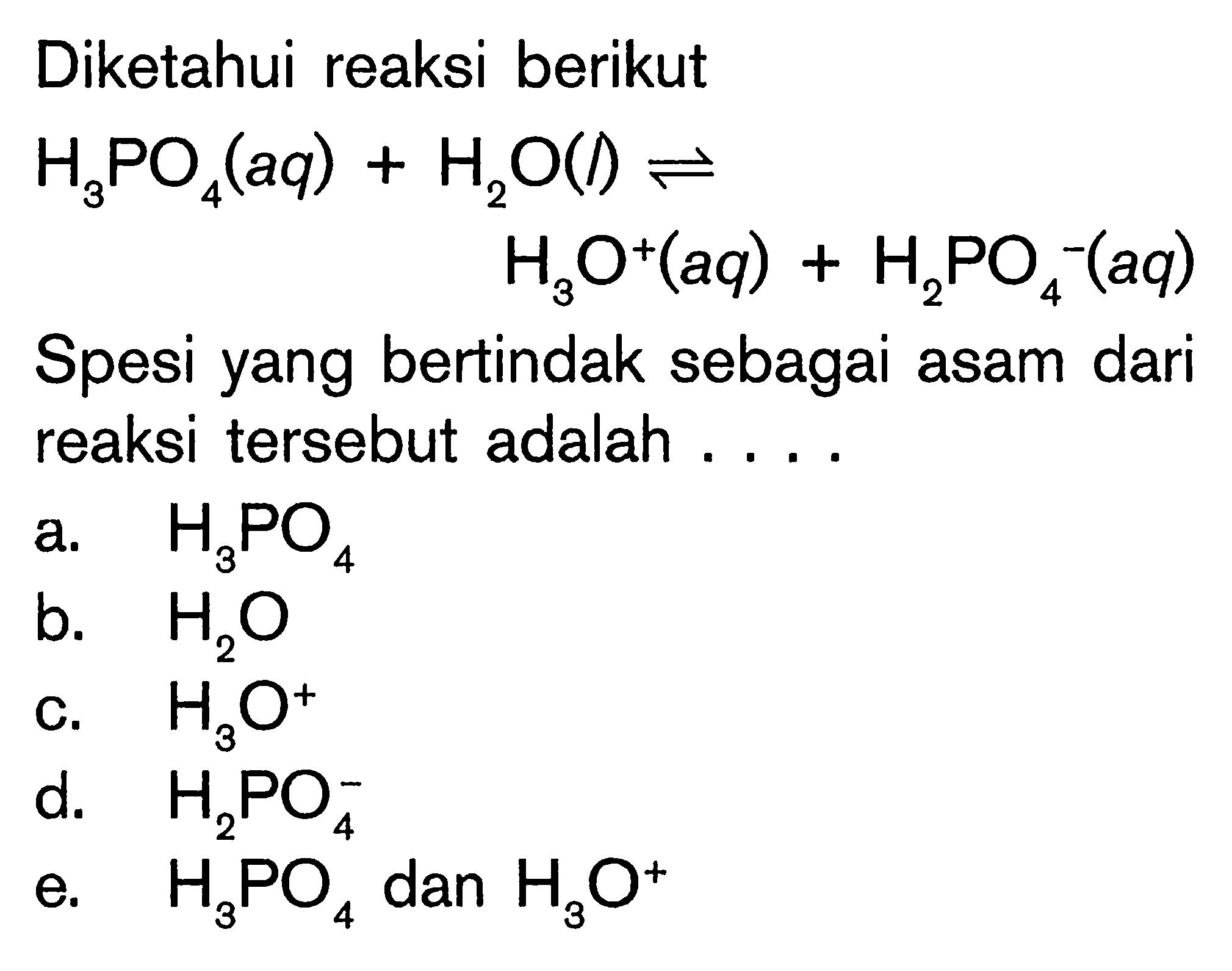
SOLVED pasangan asam basa konjugasi dari reaksi hso4(aq) + h2o(l) = h3o+(aq) + so4 2(aq) adalah
Asam = donor H+. Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20.

Tentukan pasangan asam basa konjugasi dari reaksi berikut...
Berdasarkan teori asam basa Bronsted-Lowry, jika dalam suatu reaksi asam dan basa, apabila asam mendonorkan protonnya, maka akan dihasilkan spesies basa konjugasi, sedangkan basa yang menerima proton akan menghasilkan spesies asam konjugasi. Nah, itulah yang dimaksud dengan pasangan asam dan basa konjugasi. Untuk lebih mudahnya, perhatikan 23 pasangan asam dan basa konjugasi berikut: No. Asam

Cara Mencari Pasangan Asam Basa Menurut Teori Bronsted Lowry AsamBasa YouTube
Tentukan pasangan asam basa konjugasi pada persamaan kimia berikut! H2O(l) + NH3(aq) → OH-(aq) + NH4+(aq) Jawaban: Persamaan kimia menunjukkan air (H2O) yang bereaksi dengan ammonia (NH3). Air bertindak sebagai asam di mana air akan melepaskan proton (H+) yang kemudian ditangkap oleh ammonia.

Tentukan Pasangan Asam Bronsted Lowry Dari Senyawa Basa Hso4 Mobile Legends
Tentukan pasangan asam-basa konjugasi dalam reaksi-reaksi berikut! HClO ( a q ) + CH 3 NH 2 ( a q ) ⇌ CH 3 NH 3 + ( a q ) + ClO − ( a q ) 1. 0.0. Jawaban terverifikasi. Pada persamaan reaksi berikut, tentukan spesi manakah yang bertindak sebagai asam atau basa! Tunjukkan pasangan basa konjugatnya!

tentukan pasangan asam konjugasi dan basa konjugasi dari HSO4+CO32>SO42+HCo3 Brainly.co.id
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H +) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen.Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Tentukan Pasangan Asam Basa Konjugasi Dari Reaksi Berikut Homecare24
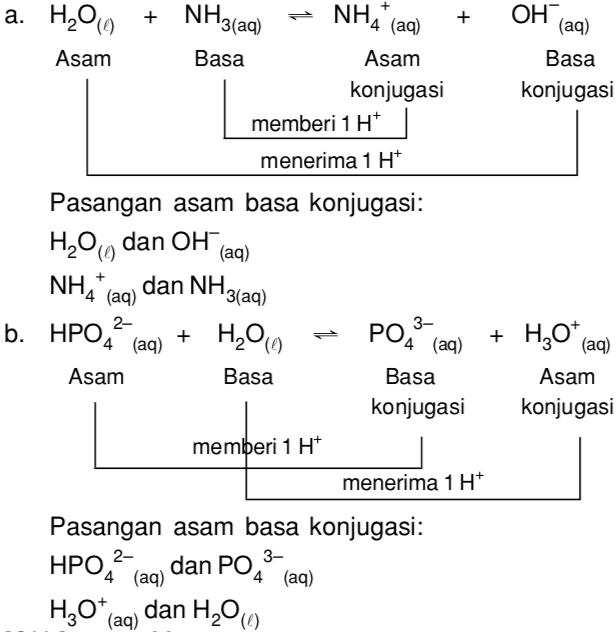
Pada teori asam basa Bronsted-Lowry dikenal istilah pasangan asam basa konjugasi. Pasangan asam basa konjugasi adalah dua spesi yang memiliki perbedaan hanya pada satu ion saja. Reaksi yang terjadi: Pasangan asam-basa konjugasi adalah dan serta dan Jadi, pasangan asam-basa konjugasi adalah dan serta H 2 O dan .

Trik Menentukan Pasangan Asam Basa Konjugasi KIMIA OKE PINTAR
Reaksi yang terjadi: mendonorkan 1 ion kepada , sehingga adalah asam dan adalah basa. yang telah kehilangan 1 ion dan disebut basa konjugasi, sedangkan yang telah menangkap 1 1 ion dan disebut asam konjugasi. Pasangan asam-basa konjugasi = dan. Pasangan basa-asam konjugasi = dan. Jadi, pasangan asam-basa konjugasi adalah dan .

Menentukan Asam Basa Konjugat BronstedLowry YouTube
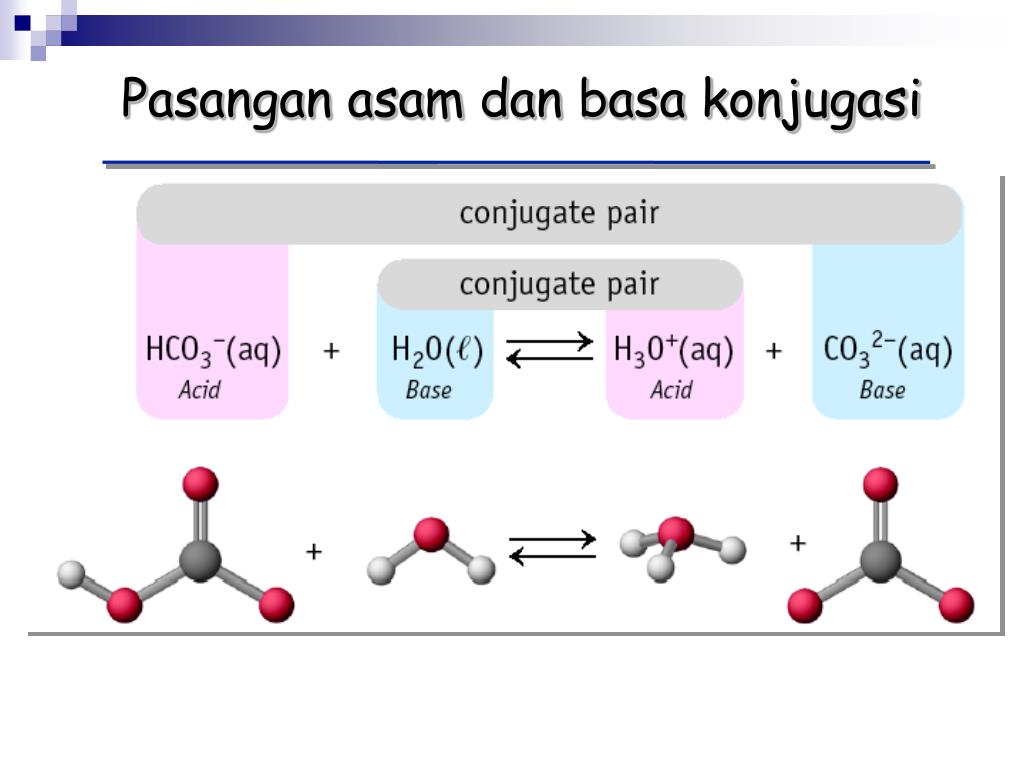
H 2 O dan H 3 O + merupakan pasangan asam-basa konjugasi. H 2 O adalah basa konjugasi dari H 3 O + dan H 3 O + adalah asam konjugasi dari H 2 O. Contoh Soal Asam dan Basa Konjugasi. Berikut ini contoh pasangan asam-basa konjugasi pada beberapa reaksi. a. HNO 3(aq) + H 2 O (l) ⇄H 3 O + (aq) + NO 3.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Teori Asam-Basa Bronsted Lowry Asam = zat yang dapat memberikan proton Basa = zat yang dapat menerima proton a. HCO 3 − ( a q ) + OH − ( a q ) → CO 3 2 − ( a q ) + H 2 O ( l ) Asam Basa Basa Asam Konjugasi Konjugasi sehingga pasangan asam-basa konjugasi = dan b.
Asam Dan Basa Konjugasi Dengan Contoh Soal Rumus Kimia Riset
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Tentukan pasangan asam-b.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
Asam lemah: HA + H 2 O ⇌ H 3 O + + A - (basa kuat) Basa sesaat setelah menerima proton akan berubah menjadi asam konjugasi dari basa tersebut. Contoh tipe reaksi: Basa kuat: B + H + → BH + (asam lemah) Bila ditulis secara lengkap: Basa kuat: B + H 3 O + → BH + (asam lemah) + H 2 O. Basa lemah: B + H + ⇌ BH + (asam kuat) Bila ditulis.

Tunjukkan pasangan asam basa konjugasi pada reaksi...
Non-nukleofilik. Lemah. l. b. s. Asam konjugasi dapat digambarkan dengan menggunakan reaksi kimia berikut: Asam + Basa Basa Konjugasi + Asam Konjugasi. Johannes Nicolaus Brønsted (kiri) dan Martin Lowry (kanan). Johannes Nicolaus Brønsted dan Martin Lowry memperkenalkan teori Brønsted-Lowry, yang mengusulkan bahwa senyawa manapun yang.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Tentukan rumus basa konjugasi dari NH4+ Jawaban: Rumus cepatnya adalah Basa Konjugasi : -1 H spesies maka NH4+ itu basa konjugasinya menjadi NH3. 2. Berdasarkan reaksi berikut:. Pasangan asam basa konjugasi cirinya adalah kemiripan rumus kimia dengan selisih jumlah H sebanyak satu atom H.